自發性反應的迷失(下)
自發性反應的迷失(下) The misconception of spontaneous reaction (II)
國立臺灣師範大學化學系兼任教授 邱智宏教授
連結:自發性反應的迷失(上)
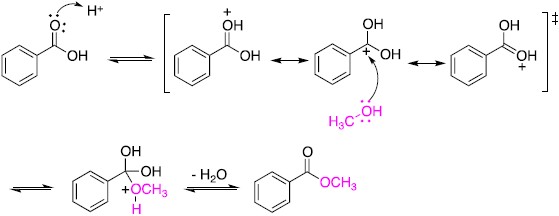
二、碳酸水溶液中的反應
上面的例子發生在家庭的藥箱裏,接下來轉到廚房的冰箱中最常看到碳酸飲料,為了簡化討論,將添加的色素、香料及甜劑均排除,僅探討碳酸水溶液,即將 $$\mathrm{CO_2}$$ 溶在水中的反應。儘管 $$\mathrm{CO_2}$$ 溶在水中後會有微量的碳酸、碳酸氫根及氫離子產生如下:
$$\mathrm{CO_{2(aq)}+H_2O_{(l)}\rightleftharpoons H_2CO_{3(aq)}\rightleftharpoons H^+_{(aq)}+{HCO_3}^-_{(aq)}}$$ (式-3)