溫度對反應速率的影響
溫度對反應速率的影響 (The Effect of Temperature on Reaction Rate)
國立林口高級中學化學科林明祥老師/國立臺灣大學化學系陳藹然博士責任編輯
東西吃不完怎辦?放到冰箱去避免食物腐敗;鎂帶放到加了酚酞的熱水裡,一下子鎂帶就冒泡且溶液變成桃紅色。兩者表面上看起來是完全沒有關係的事,實際上他們卻傳達了一個相同的概念:溫度影響了反應速率。十九世紀末瑞典化學家阿瑞尼士(Svante Arrhenius, 1859-1927)探討溫度與反應速率的關係,發現速率常數k(rate constant)的自然對數和絕對溫度T的倒數呈正比,又稱為「阿瑞尼士行為 (Arrhenius behavior)」。
ln k = b (1/T) + a (a, b 常數)
上式積分得k=![]()
A為頻率因子(frequency factor)和碰撞頻率與位相有關;Ea為反應活化能(activation energy)。
反應活化能,大家比較熟悉,「頻率因子」可能瞭解的人就不多了。要解釋頻率因子就必須先瞭解化學反應是如何發生的。化學反應的發生來自於分子之間的原子重組,有化學鍵的斷裂與生成;兩個分子之間要發生反應必須先發生碰撞,這就是「碰撞學說(collision theory)」的濫觴。根據碰撞學說(collision theory),反應的發生來自於反應分子間產生有效碰撞,有效碰撞必須符合兩大必要條件:能量足夠及位相(Orientation)正確。因此反應速率與有效碰撞頻率成正比,只要能提升有效碰撞頻率,也就能加速反應速率。頻率因子即是考慮了分子間的有效碰撞參數,包含了(1) 碰撞頻率、(2) 位相因素、(3) 分子擁有足夠能量的碰撞比率(即分子能量E > Ea)。
根據生活經驗大家都知道溫度上升會加速反應的進行,但是溫度的改變是如何影響反應速率呢?最直覺的想法是:溫度上升使分子運動速度加快,造成分子碰撞頻率增加,所以反應速率加快。用個例子來檢驗一下這個假設的對錯;參考書和老師說常溫附近溫度每增加10℃時反應速率會加倍。首先,我們考慮溫度對「碰撞頻率」的影響。當溫度上升時,粒子的運動速率會變快。例如溫度由25℃上升至35℃時,根據分子動能和溫度的關係,
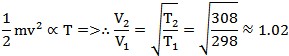
得知當粒子的的溫度由25℃上升至35℃其運動速率增加約2%,又粒子運動速率與碰撞頻率成正比,所以碰撞頻率也增加約 2 %。對照前面提到室溫附近(25℃)反應速率上升10℃ 反應速率增倍的經驗而言,顯示溫度上升、粒子動能增加、碰撞頻率增加絕對不是影響反應速率的主因。究竟溫度上升,什麼才是使反應速率增快的主因呢?碰撞學說告訴我們:反應的發生來自於反應分子間產生有效碰撞,即能量足夠的分子以對的方位互撞才能反應。所以真正影響反應速率的是溫度上升讓帶有足夠能量的分子增加了,足夠的能量即是超過反應活化能的能量。
回到「參考書和老師說常溫附近溫度每增加10℃時反應速率會加倍」,這個觀察是不是適用於所有的反應。已知
k=Ae-Ea/RT 或 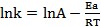
故 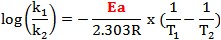
若反應溫度由25℃升高為35℃,某反應的反應速率增為2倍,代入以上關係式:
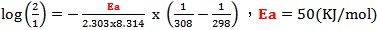
因此我們可推論「溫度每增加10℃,反應速率增加2倍」只適用於常溫附近,且活化能約50(KJ/mol)的反應。
參考資料
1. 曾國輝,《化學(上冊)第二版》,藝軒圖書出版社,第468-470頁,2001年1月。
2. 陳秋炳等人,《高中化學(下)教師手冊》,翰林出版社,第11頁,2010年再版。
3. P.W. Atkins,《Physical Chemistry》Fifth edition,OXFORD,p877-p878,1994。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 

對不起 ……我想請問一下 ……為什麼溫度每升高10℃,反應速率會增加大約為兩倍 ???