催化劑
催化劑 (Catalyst)
國立臺灣大學化學系學士生陳佳翰/國立臺灣大學化學系陳藹然博士責任編輯
催化劑(Catalyst)又稱觸媒,是一種以改變反應途徑的方式來影響反應活化能,藉以增快或減慢化學反應,但反應前後卻質量不變的物質。例如:某催化 劑A能降低反應活化能30 kJ/mol,則根據阿瑞尼亞士方程計算,在體溫37℃(310 K)下,反應速率約增快113540倍。
![]() 催化劑可分為三大類:
催化劑可分為三大類:
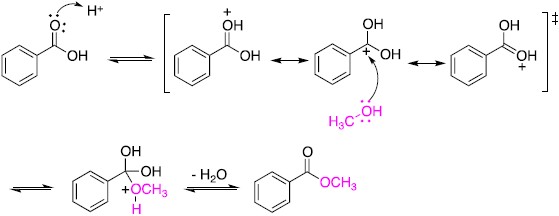
1. 均相觸媒或勻相觸媒(homogeneous catalyst)。此類催化劑與反應系統同一相態如液相或氣相,觸媒和反應物能均勻混合,因此在催化過程中並沒有受到觸媒與反應物接觸表面積大小的限 制。常見的酸催化酯化反應(acid-catalyzed esterification)即為在有機酸溶液中添加些許硫酸作為催化劑,使得羧酸基團(C(=O)(OH))上C=O的氧原子被質子(H+)活化形成活化錯合體(activated complex),醇的氧原子攻擊此活化錯合體中帶部份正電的碳原子,得到反應中間體(intermediate),最後脫去一分子水得到酯類(圖一)。
勻相催化劑最主要有三大類:酸催化(Acid catalysis)、有機金屬催化(Organometallic chemistry)及其他(other)上面所提的例子就是一個很好的酸催化例子。而像齊格勒-納塔催化劑(Ziegler-Natta catalyst) 著名的有機金屬催化劑,主要是針對聚合反應(polymerization)。目前在工業界應用最成功的例子是以銥的錯離子[Ir(CO)2I2]–,催化甲醇與一氧化碳反應生成無水的冰醋酸。Cativa催化法(Cativa process)是目前最主要用來製備冰醋酸的方式。
不過,勻相催化劑也正因觸媒與反應系是勻相混合,使得催化劑分離、回收相當困難;產物的高純化成本與催化劑的低重複使用率成了這類觸媒的最大缺點,不像異相催化直接將催化劑移除即可,在勻相催化劑中,最常見的分離方式是蒸餾跟萃取。
2. 異相催化劑(heterogeneous catalyst),與勻相催化劑恰恰相反,異相催化劑多為固相,並與固、液、氣或超臨界流體相的反應系混合進行催化反應。正因如此,異相催化劑的分離相 當簡單,以物理方式如過濾或離心就可以將催化劑與產物分離。可重複使用次數高和低分離成本是這類催化劑的優點。異相催化劑的應用相當多,例如:石化產業常 以沸石(zeolite)作為酸觸媒,催化長碳鏈的原油裂解(cracking)來產生碳鏈較短的汽油,以及化學肥料產業用哈柏法(Haber Process)製氨等。
異相催化劑雖然方便分離,但也因為物理相不同,在機制上,只能催化吸附在其表面上的分子;如圖三,一定要等生成物離去後,反應物才能再次附著。故催化劑總表面積大小與分子擴散速率快慢,是影響異相觸媒催化效率的重要因素。
3. 酵素(enzyme),為生物界中的催化劑,是一種具有高催化活性、高催化效率的蛋白質或 核酸分子,藉由活性區塊上的官能基團或金屬中心與活化複體作用,能大幅降低活化能並提升反應速率,其催化效率大約是勻相催化劑的100~100000倍。 值得一提的一點,酵素的活性區塊大多深埋於分子內部,此一舉動能讓活性區塊避開水分子的干擾,使得官能基團或金屬中心仍保有高帶電性、高反應性;因此,有 趣的是,酵素雖然是以勻相方式與反應系作混合,但因活性中心位於分子內部,與異相催化劑相同,亦受分子擴散速率限制。除了高活性以外,酵素還擁有高專一 性、可調節性的優點;只可惜其催化能力極易因環境的溫度、pH值的改變而失活。另外,酵素的反應系只能在水溶液中進行,在生成物除水這一步中多出了許多困 難跟成本,也使得反應種類的選擇上受限相當大。例如最近推行的「生質柴油(biodiesel)試行計畫」,所加入油箱裡的生質柴油因含微量水份,故能添 加比例有限,且易使油路管線與引擎受損。
雖然催化劑在反應的過程中不會被消耗,但有可能會與副產物結合而改變其化學性質,進而失去活性;此現象稱之為「毒化(poisoning)」。例如:直接 甲醇燃料電池(direct methanol fuel cell)是以鉑作為陽極,使得反應物甲醇被氧化而放出電子。
![]() 此反應所產生的一氧化碳會牢牢地附著在鉑金陽極表面,使得陽電極失去催化能力;電池的轉化能力亦隨之而停擺。
此反應所產生的一氧化碳會牢牢地附著在鉑金陽極表面,使得陽電極失去催化能力;電池的轉化能力亦隨之而停擺。
參考資料
1. C.N. Satterfield, Heterogeneous Catalysis in Industrial Practice, 2nd ed., McGraw-Hill Book Company, 1991.
2. G.C. Bond, Heterogeneous Catalysis- Principles and Applications, 2nd ed., Oxford Science Publications, 1987.
3. J.M. Thomas and W.J. Thomas, Principles and Practice of Heterogeneous Catalysis, VCH, Weinheim, 1997.
4. Sunley, G. J.; Watson, D. J. Catalysis Today 2000, 58, 293-307.
5. Wikipedia– Homogeneous catalysis http://en.wikipedia.org/wiki/Homogeneous_catalysis
6. Wikipedia– Cativa process http://en.wikipedia.org/wiki/Cativa_process




 前一篇文章
前一篇文章 下一篇文章
下一篇文章 原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  化學的填字遊戲?
化學的填字遊戲?  強化玻璃
強化玻璃 
