熔點以下的水會自發性結成冰的原因-環境熵和系統熵一樣重要(一)
The reason of water would spontaneously turn into ice when the temperature is below the melting point – the surrounding entropy is as important as system entropy (I)
國立臺灣師範大學化學系兼任教師 邱智宏
熱力學第二定律有許多不同面相的敘述,其中一種說法為:當系統內一個自發性的程序 (spontaneous process) 進行時,系統 (system) 和環境 (surrounding) 中所有熵 (entropy) 變化的總和會大於 $$0$$,即 $$\Delta_{tot}S>0$$(若等於 $$0$$ 則屬以可逆的情況),$$\Delta_{tot} S$$ 等於 $$\Delta_{sur}S+\Delta_{sys}S$$,其中 $$\Delta_{sur}S$$、$$\Delta_{sys}S$$ 分別代表環境熵及系統熵的變化量。
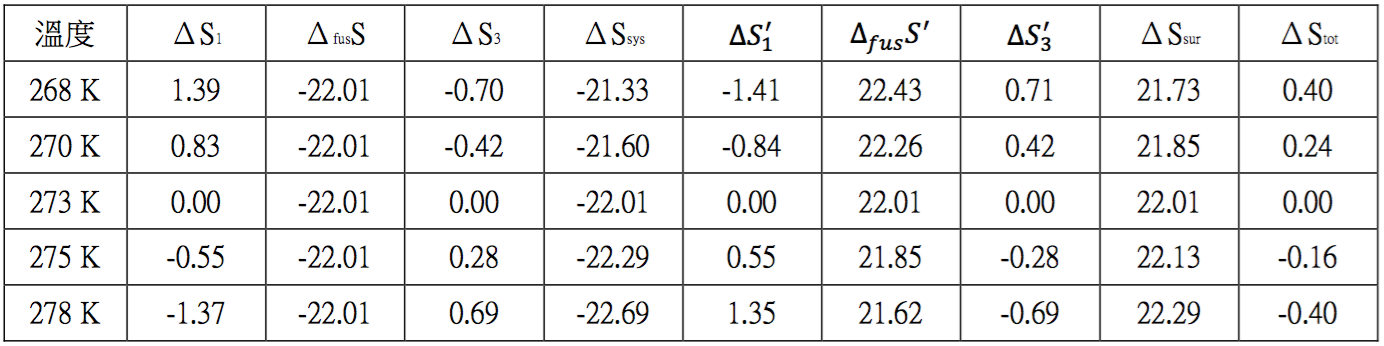
此說法中隱含著三個要素,首先系統的熵大於 $$0$$,並不一定會產生自發反應,小於 $$0$$ 也不一定不會發生,需將環境的熵一併考慮進來,方能判讀。其次自發反應必屬於不可逆 (irreversible) 反應。最後,系統和環境間,熱量的交換,除了正負號不同以外,絕對值應為相等,但是兩者最終的熵卻不相同,可見在系統及環境中一定存在改變它們的條件。
這些要素對於初學物理化學的學子來說略嫌抽象,若能透過日常生活中顯而易見的例子,例如常壓下,$$-5^\circ C$$ 的水,在室溫為 $$-5^\circ C$$ 時會自發性的結成冰,或 $$5^\circ C$$ 的冰在高於熔點的室溫下,會迅速熔化成水,將其變化過程中熵、焓的改變加以計算及說明,或許在思索、領略這些要素時,能獲得事半功倍的效果。