化學實驗室實驗:不用氫氧化鈉,「銅銀金幣」變變變〔I〕
化學實驗室實驗:不用氫氧化鈉,「銅銀金幣」變變變(Turning Pennies into Silver and Gold without using Sodium Hydroxide)〔I〕
國立台中高級工業職業學校化工科陸冠輝老師 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義(Student Handout)
實驗介紹
古代的方術之士有一種叫做「點石成金」的招術,此招術有如魔術師般地點銅成銀以及點銅成金,真是神奇極了。本實驗試圖利用鋅粉和氯化鋅水溶液,浸煮壹元銅幣,先變成「銀幣」,然後以電熱板加熱,變成「金幣」,如圖一所示。由於本實驗有別於傳統上使用氫氧化鈉溶液,因此煮沸過程不會產生刺鼻難聞的味道,不需要在抽風櫃內進行。
在煮沸的鋅粉和氯化鋅水溶液中,壹元銅幣的表面逐漸地變成「銀幣」,這到底發生什麼化學反應呢?為了找到答案,(1)首先探討在鋅粉和氯化鋅溶液中含有哪 些物種(species),(2)然後找出這些物種的標準還原電位(standard reduction potentials)或標準氧化電位,(3)最後找出可能配對最大反應電位之氧化還原反應,進而推知發生什麼化學反應。
首先,由於氯化鋅水溶液是酸性的,其pH值約為4,因此壹元銅幣在鋅粉不氯化鋅水溶液中的主要物種含有:Zn(s)、Zn2+(aq)、Cl-(aq)、H2O(l)、Cu(s)和H+(aq)。
然後,這些物種的標準氧化電位分別如反應式[1]~[5]所示,標準還原電位分別如反應式[6]~[8]所示:
Zn(s) → Zn2+(aq) + 2e- Eoxo = 0.76 V [1] 2Cl-(aq) → Cl2(g) + 2e- Eoxo = -1.36 V [2] 2H2O(l) → O2(g) + 4H+(aq) + 4e- Eoxo = -1.23 V [3] Cu(s) → Cu2+(aq) + 2e- Eoxo = -0.34 V [4] Cu(s) → Cu+(aq) + e- Eoxo = -0.52 V [5]
2H+(aq) + 2e- → H2(g) Ereo = 0.00 V [6] Zn2+(aq) + 2e- → Zn(s) Ereo = -0.76 V [7] 2H2O(l) + 2e- → H2(g) + 2OH-(aq) Ereo = -0.83 V [8]
最後,找出可能配對最大反應電位之氧化還原反應。第一反應應該為反應式[1]與反應式[6]發生的氧化還原反應,因為其反應電位為0.76 V,為最大反應電位者,亦即此反應為鋅粉在酸性溶液進行氧化還原反應,如反應式[9]所示。第二反應應該為反應式[1]和反應式[7]的氧化還原反應,其 反應電位為0.00 V,亦即此反應為來自鋅粉的鋅與來自鋅反應的產物之鋅離子進行氧化還原反應,如反應式[10]所示。
Zn(s) → Zn2+(aq) + 2e- Eoxo = 0.76 V [1]
2H+(aq) + 2e- → H2(g) Ereo = 0.00 V [6]
—————————————————————————-
Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g) Eo = 0.76 V [9]
Zn(s)(來自鋅粉) → Zn2+(aq) + 2e- Eoxo = 0.76 V [1]
Zn2+(aq)(來自鋅反應的產物) + 2e- → Zn(s) Ereo = -0.76 V [7]
————————————————————————————–
Zn(s)(來自鋅粉) → Zn (s)(鍍在壹元銅幣上) Eo = 0.00 V [10]
另外,為何壹元銅幣鍍上銀白色的鋅需要加熱?這可以利用熱力學公式[11]來說明,其中△G為自由能變化(free energy change),△H為焓變化(enthalpy change),△S熵變化(entropy change)。
△G = △H -T△S [11]
就反應式[9]而言,此反應為放熱反應,由於從室溫加熱到沸騰之△H值的變化不大,因此△G值的變化也不大。另一方面,此反應有氫氣生成,△S為正值,由於加熱T變大,而使得-T△S值的變化更為負值,因此△G值的變化更為負值。亦即,加熱的條件是有利於壹元銅幣鍍上銀白色的鋅。
還有,為何銀色的壹元硬幣(「銀幣」)放置在電熱板上加熱會變成金黃色的硬幣(「金幣」)?這是因為固體的金屬鋅和金屬銅加熱熔化變成液態的金屬鋅和金屬銅,然後均勻混合而變成鋅銅合金(黃銅),涉及的物理變化如過程[12]所示:
Zn(s) + Cu(s) → Zn(l) + Cu(l) → 鋅銅合金(黃銅) [12]
這個反物理變化必需加熱才能使金屬鋅與金屬銅熔化並混合在一起,形成黃銅(brass)。黃銅是紅銅及鋅的合金,因色黃而得名。銅含量62%~68%的黃 銅,其熔點為934~967℃。黃銅的機械性能和耐磨性能都很好,可用於製造精密儀器、船舶的零件等。含鋅量不同,也會有不同的顏色,如含鋅量為 18%-20%會呈紅黃色,而含鋅量為20%-30%就會呈棕黃色。王子的金屬(Prince’s metal)或魯伯特王子的金屬(Prince Rupert’s metal)是一種黃銅的類型,含75%的銅和25%的鋅,其美麗的金黃顏色,被用作仿金。因此,若想要使壹元硬幣看起來像金幣,則硬幣表面的合金中金屬 的比率必須大一些。
藥品與器材
1. 壹元硬幣 3個/組
2. 電熱板 1台/組
3. 燒杯(100 mL) 4個/組
4. 乳膠手套 /組
5. 金屬鑷子 2支/組
6. 氯化鋅(Zinc chloride,ZnCl2) 7克/組
7. 鋅粉(Zinc powder) 1克/組
8. 1 M醋酸(Acetic acid)或食用醋(vinegar) 20 mL/組
9. 蒸餾水 200 mL/組
實驗步驟
1. 清洗壹元銅幣:以20 mL的1 M醋酸或食用醋溶液清洗壹元銅幣,以去除銅鏽。註:本實驗最好使用製造年代較新的且較乾淨的銅幣。
2. 秤取約7公克的固體氯化鋅,放置於100 mL的燒杯中,加50 mL的蒸餾水,並攪拌溶解之。
3. 秤取約2 g的鋅粉,加入上述的燒杯中,並攪拌均勻之。
4. 放置混合的鋅粉和氯化鋅溶液於電熱板上,使其加熱至沸騰,如圖二所示。
5. 當溶液達沸騰時,偶爾以金屬鑷子夾起壹元硬幣,在溶液中翻轉,使整個硬幣完整且充分反應,如圖三所示。
6. 當壹元銅幣完全變成銀灰色時,以金屬鑷子夾起,在蒸餾水中清洗之,即完成壹元銅幣變身成為銀色的壹元硬幣(「銀幣」),如圖四所示。
7. 清洗後的銀色的壹元硬幣放置在已達高熱的電熱板上,經數秒鐘的時間,可以看見銀色的壹元硬幣轉變成黃色的壹元硬幣,如圖五所示。
8. 用金屬鑷子夾起金黃色的壹元硬幣,放入冷的蒸餾水中,可聽見「嘶~ ~」的聲音,壹元硬幣變得更加閃亮,即可完成銀色的硬幣變身成為黃金色的壹元硬幣(「金幣」),如圖六所示。
9. 清洗另一個壹元銅幣,置入步驟4之鋅粉和氯化鋅的混合溶液,重複步驟5-6,製作壹元銅幣變身成為銀色的壹元硬幣(「銀幣」)。
10. 放置壹元銅幣、銀色的壹元硬幣(「銀幣」)和金黃色的壹元硬幣(「金幣」)在桌面上,拍照此三枚硬幣並貼在下面的「實驗記錄」中。
11. 放置「銀幣」和「金幣」在高熱的電熱板上加熱,恢復為原來的銅幣。
安全和注意
● 進行實驗操作時,應該戴可丟棄的手套,也應該穿實驗衣。
● 若對實驗的安全問題有任何質疑,請勿猶豫,立刻詢問老師。
● 不慎接觸藥品,應該用大量水沖洗,必要時報告老師。
● 本實驗在加熱過程中,應注意溫度的變化,避免身體碰觸高熱而燙傷。
廢棄物處理
● 廢棄之溶液應集中到標示「重金屬類」的回放桶中。
觀察紀錄
拍照壹元銅幣、銀色的壹元硬幣(「銀幣」)和黃金色的壹元硬幣(「金幣」)並張貼於此處。
問題
1. 壹元銅幣的顏色之變化為何?
2. 本實驗可以製造出或產生什麼物質?請區分這些物質是元素、化合物或混合物。
3. 壹元銅幣變成銀色的壹元硬幣,以及變成黃金色的壹元硬幣是物理變化,還是化學變化?
4. 常見之銅的合金有哪些?本實驗中的「金幣」是哪一種合金?比例不同會有顏色上的差異嗎?


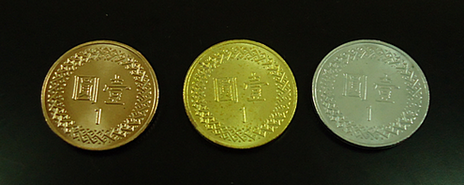





 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  中間體與穩定狀態近似法
中間體與穩定狀態近似法  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定 

請問電熱板是否可以改用酒精燈加熱?