碳烯
碳烯 (Carbene)
國立臺灣師範大學化學系胡婷嘉研究生
碳烯(carbene) 又稱為卡賓,是碳中心經由兩個共價鍵結合兩個基團,且有兩個未鍵結電子的電中性分子(沒有形式電荷 formal charge)。是一種十分不穩定的中間體。
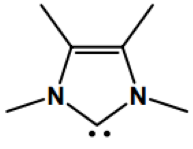
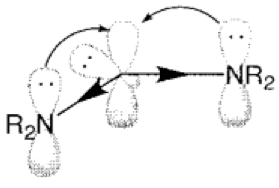
雖然他是電中性但因為它周圍只有六個電子並不符合八隅體,所以為高度缺電子且反應性很高的中間體。最簡單的碳烯為亞甲基碳烯(圖一),但她非常不穩定,所以沒有被分離出來過。現在有一些含氮的雜環碳烯(N-heterocyclic Carbene),又稱為穩定碳烯(圖二)。因氮上的孤對電子對可以使缺電子的碳烯穩定(圖三),且氮的電負度比碳大,故可以穩定碳烯的孤對電子,使含氮的碳烯更穩定,甚至可以被單獨分離出來。
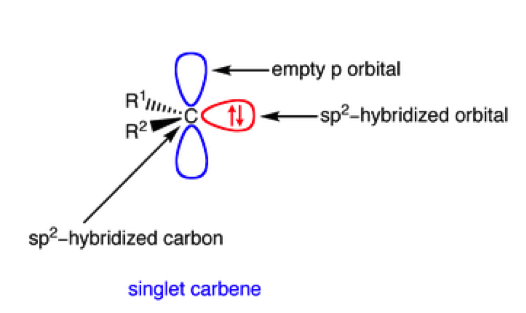
碳烯的結構是由碳兩個 $$\sigma$$ 鍵和兩個自由電子所組成的線型構型(diagonal)。而兩個自由電子可以是成對的在 $$sp^2$$ 軌域中。電子不是在 $$p$$ 軌域的原因是因為當電子在 $$sp^2$$ 軌域中時有較多的 $$s$$ 軌域性質,使電子較接近帶正電的原子核,可以穩定分子的結構。如圖四。有這樣電子分布的碳烯我們稱它為單重態碳烯(singlet carbene)。
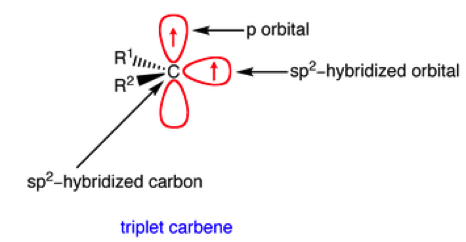
另一種電子分布是兩個自由電子未成對,分別分布在 $$p$$ 軌域和 $$sp^2$$ 軌域上。如圖五。兩個電子分別在兩個軌域上,所以有很像自由基的反應性。我們稱它為三重態碳烯(triplet carbene)
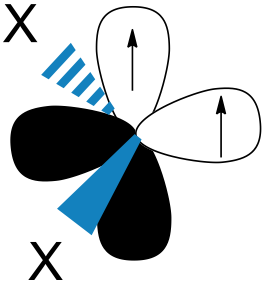
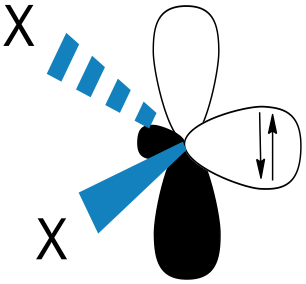
一般來說,單重態的分子會比三重態穩定,但因為碳烯兩個自由電子和兩個空軌道,在理論上,三重態應該是比較穩定的。因為電子的分布不同,所以兩種碳烯的鍵角也會不同。圖六-A是三重態碳烯,鍵角在 $$125-140^\circ$$ 之間,圖六-B是單重態碳烯,鍵角為 $$102^\circ$$。
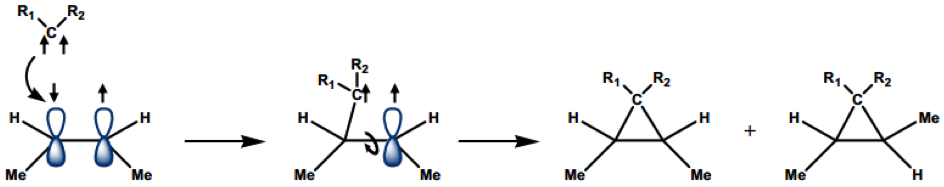
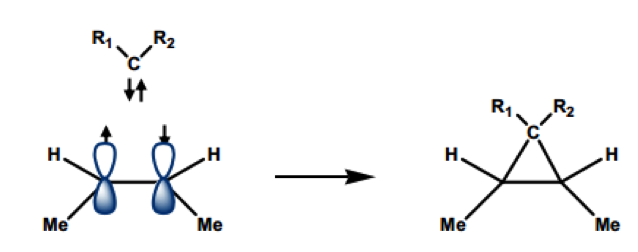
單重態碳烯中,兩個電子成對在 $$sp^2$$ 軌域上,所以可以吸引缺電子的分子來鍵結(親和性),還有兩個空的 $$p$$ 軌域會吸引帶負電的分子來鍵結(親電性),有雙向的性質。而三重態卡賓的兩個自由電子不成對分布在兩個軌域上,所以需要有可以分享電子的分子才能鍵結。這兩種卡賓在反應性上也有不同,可以從產物得知他們是哪種卡賓。
參考資料:
- http://zh.wikipedia.org/wiki/%E4%BA%9A%E7%94%B2%E5%9F%BA 圖一
- Arduengo, A. J.;Rasika Dias, H.V.; Harlow, R. L.; Kline, M. J. Am. Chem. Soc. 1992, 114,5530. 圖二
- http://140.123.79.90/~mike1234/FINAL%20DATA/REF/3.pdf 圖三
- http://science.uvu.edu/ochem/index.php/alphabetical/c-d/carbene/ 圖四,圖五
- Bauschlicher, C. W.; Schaefer, H.F. III; Bagus, P.S.; J. Am. Chem. Soc., 1977, 7106.圖六
- http://www.chem.wisc.edu/areas/organic/studsemin/hansen/Hansen-sem.pdf 圖七圖八


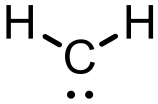
 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  化學傳記:法拉第不為人知的一面(八):電解定律
化學傳記:法拉第不為人知的一面(八):電解定律 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 

感謝分享