疫苗
血清、抗體、佐劑、基因疫苗
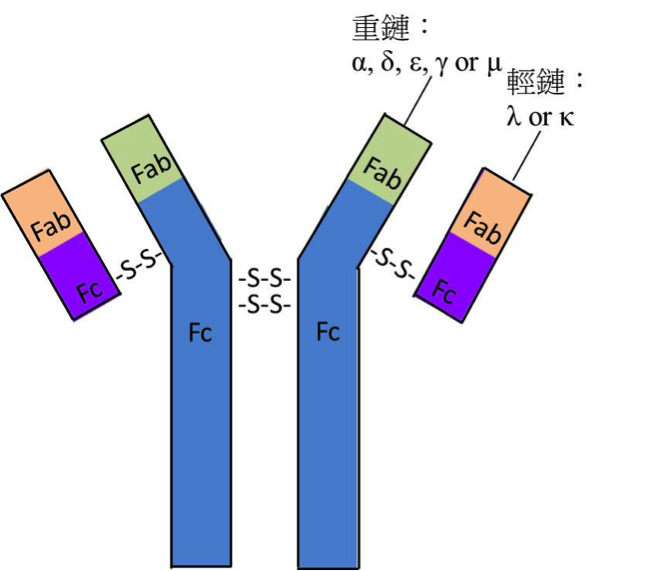
人類抗體的同型
人類抗體的同型 (Antibody isotypes)
國立臺灣大學生命科學系101年陳巧坪博士生
抗體 (antibody) 又稱為免疫球蛋白 (immunoglobulin,Ig),主要由參與體液性免疫 (humoral immunity) 之B細胞經活化成為漿細胞 (plasma cell) 後所分泌,在人體內有五種不同的抗體,稱為同型 (isotype),分別為 IgA、IgD、IgE、IgG及IgM,它們各具有不同的免疫功能。
抗體皆由Y字型的單體所構成,此Y字型單體包含兩條較長之重鏈 (heavy chain) 及兩條較短之輕鏈 (light chain),共四條多肽鏈 (polypeptide chain),四條多肽鏈間由雙硫鍵 (disulfide bond) 連接。
還三合一疫苗一個清白
還三合一疫苗一個清白
高瞻計畫特約編譯 柯廷龍/國立臺灣師範大學生命科學系 李冠群副教授責任編輯
編譯來源:Huge Meta-Study Of Vaccines Reveals No Link To Autism
曾經有研究指出接受施打麻疹、腮腺炎、德國麻疹三合一疫苗(measles, mumps and rubella vaccine, MMR vaccine)可能是造成自閉症(autism)的元兇之一。然而在那之後,許多的更有效力的研究以及證據否定了原先的調查結果。
2014年5月,位於澳洲雪梨大學The Whiteley-Martin研究中心的學者們所發表的最新研究成果再度證明了三合一疫苗和自閉症並不相關。1
這次的研究範圍廣闊,結合了兩種調查,第一種研究運用統計方法執行了5項調查共包含1,256,407位孩童的資訊,觀察施打疫苗後出現自閉症症狀的患者以及其他無疫苗副作用的對象之間的比例。第二種以病例對照研究方法(case-control study)2對9920位兒童進行觀察,比對那些在接受疫苗後,罹患自閉症症狀的病患與其他施打疫苗後身體沒有不適的兒童。
益生菌口服疫苗治療C型肝炎
益生菌口服疫苗治療C型肝炎
國立臺灣大學生命科學系范姜文榮編譯/國立臺灣師範大學生命科學系李冠群副教授責任編輯
編譯來源:科学技術振興機構(JST)
日本神戶大學為主的研究團隊,透過與日本科學技術振興機構及國際協力機構的合作,成功開發出治療C型肝炎的益生菌1口服新型疫苗,可望能提高C型肝炎的標準治療法的治癒率。該研究成果刊載於近期疫苗科學期刊「Vaccine」線上版。
C型肝炎病毒的慢性感染病患,據估計世界上有高達1億8千萬人以上,這些患者易發展成肝臟相關疾病,如肝硬化或肝癌。日本神戶大學的研究團隊,經研究估計在開發中國家印尼也有約700萬的慢性感染病患,但目前的治療藥物價格相當高,無法提供給許多人有效的治療。
目前C型肝炎的標準治療法,是使用長效型干擾素2及抗病毒核酸誘導體(ribavirin)兩者併用療法,或者再加上NS3蛋白酶抑制劑之三者併用療法。在日本C型肝炎病毒基因型1b的感染者,經使用兩者併用療法,約50%未能成功治療;即使三者併用療法,仍約30%患者未能成功治療,因此有必要去開發更有效的治療法。
C型肝炎患者對C型肝炎病毒的免疫反應微弱,是導致C型肝炎易於慢性化、難於治療的原因之一。若能增強患者對C型肝炎病毒的專一性細胞性免疫力,應能提高標準治療法的治癒率。到目前為止,治療疫苗雖有研究報告提及製造基改病毒,來誘導C型肝炎病毒的專一性細胞免疫反應,但因活體基改病毒會受到基改生物相關法律的規範,無法立即進行臨床應用。
單株抗體—HAT培養基(HAT medium)
單株抗體—HAT培養基(HAT medium)
國立臺灣大學醫學系林祐民、臺北市立建國高中劉翠華教師
關於單株抗體(monoclonal antibody)的背景與原理請參閱國科會高瞻計畫自然科學教學資源平台—單株抗體(上)及單株抗體(下),本篇著重於介紹在單株抗體的細胞融合實驗中常被使用的 HAT 培養基(HAT medium)。
細胞融合是單株抗體製作過程中的一項重要技術,將 B 細胞與骨髓瘤細胞(myeloma cell)融合,融合後產生的細胞稱為融合瘤(hybridoma),融合瘤同時具有 B 細胞分泌抗體,以及癌細胞不斷分裂而不受分裂次數限制的特性。HAT 培養基即是用以培養及篩選融合瘤細胞的培養基。
未來的疫苗:基因疫苗-下
未來的疫苗:基因疫苗 (Gene vaccine)-下
國立臺灣大學師範大學生命科學系曾信豪碩士生/國立臺灣師範大學生命科學系李冠群助理教授責任編輯
請按此連結,參閱「未來的疫苗:基因疫苗 (Gene vaccine)-上」
基因疫苗與傳統疫苗的不同之處在於基因疫苗是將病原體的抗原基因,以基因工程的方式插入細菌的質體內,做成基因疫苗,最後加入生理食鹽水中(圖一),以肌肉或皮下注射的方式打入人體內;或是將基因疫苗混入有機粒子中,再以基因槍打入體內。

圖一、基因疫苗的製作流程 ( 1、取出病原體的RNA;2、反轉錄成cDNA ;3、以病原體DNA產生抗原基因;4、將抗原基因插入細菌質體中;5、大量培養細菌並抽取細菌質體; 6、將質體混合食鹽水製做成疫苗 )
未來的疫苗:基因疫苗-上
未來的疫苗:基因疫苗 (Gene vaccine) -上
國立臺灣大學師範大學生命科學系曾信豪碩士生/國立臺灣師範大學生命科學系李冠群助理教授責任編輯
使用疫苗 (vaccine) 來提升對特定疾病的免疫力並預防疾病的發生,最早應用在十九世紀初,當時便發現事先注射毒性較弱或已死亡的病原體(例如:細菌、病毒或寄生蟲)可防止被病原體感染而減少致命的機會。大部分的疫苗都是以死亡病原體的蛋白質作為抗原 (antigen),刺激人體產生免疫反應,能在下次再接觸病原體時更容易去辨識病原體並摧毀它,不過由於病原體已死亡,無法進入人體內,因此只有B細胞會產生免疫反應,而毒殺 T 細胞 (cytotoxic T cells) 並不會有任何免疫反應,A 型肝炎和 B 型肝炎疫苗就是以此原理研發而成,但由於是以死亡的病原體作成的疫苗,其效力會隨著時間的增加而逐漸削弱,因此需要透過定期注射以增加疫苗作用效力和時間;以及有些疫苗是以滅毒後的病原體當作抗原,會引發細胞和體液免疫反應,而達到終生免疫的保護,例如天花疫苗。
疫苗(Vaccine)
疫苗(Vaccine)
新竹縣立竹東高級中學生物科何淑媛老師/國立台灣大學動物所陳俊宏教授責任編輯
由於免疫細胞具有記憶性,因此我們可以提前讓我們的免疫系統先「認識」某個特定的病原體,產生記憶性B細胞與記憶性T細胞,下次在遇到同樣的病原體時,就可以快速且大量的發生免疫反應,此即為疫苗的原理。
不過,早在我們瞭解疫苗原理的數百年前,人類已經開始應用這個想法了。在古代,天花是一個可怕的疾病,有很高的致死率,即使存活,也有嚴重的後遺症;但是有人發現若將天花患者皮膚因水痘而結的疙瘩取下,塗在尚未長過水痘嬰孩的鼻孔或傷口,這個嬰孩會出現類似天花的症狀,也有死亡的可能。但如果可以存活,那他一輩子就不會再得天花!再者,若疙瘩是來自天花症狀較輕微的人,嬰孩塗完那疙瘩的副作用也較輕。隨著絲路,這個「技術」傳到了西亞、土耳其及歐洲。1798年,英國醫師簡納(Edward Jenner)發現擠牛奶的女工會從牛隻得到類似天花的病但症狀輕微許多,而且這些女工也是終身不會得天花,所以他研究由牛身上的牛痘接種到人身上,結果大大降低了天花的傳染性與致死率。1950年,世界衛生組織決定全面性接種牛痘預防天花。1979年,天花成為第一個由地球絕跡的傳染病。疫苗(vaccine)一詞,就是來自痘病毒(vaccinia),也就是牛痘病毒(cowpox virus)的一種。
在19世紀,巴斯德(Louis Pasteur)研究出將微生物的製品處理過後,可以增強動物對抗此具毒性的微生物的能力,例如把感染狂犬病的兔子的骨髓加以乾燥處理,或是將炭疽桿菌加熱,可用在預防人的狂犬病或是羊的炭疽熱上,獲得很大的成功,因此被尊為「免疫學之父」。
登革熱病毒與疫苗 (Dengue Fever)-下
登革熱病毒與疫苗 (Dengue Fever)-下
國立苗栗高級中學生物科郭美貞老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
泰國積極研發活性減毒登革熱疫苗,並授權法國巴斯德藥廠進行安全性與有效性試驗,在泰國進行的劑量與注射處方調整試驗,結果顯示有九成受試者可獲得對抗四種型別登革熱病毒的保護力。
但目前試驗中的疫苗發生的問題包括了
(1)副作用:單一型別疫苗的副作用很輕微,但能夠預防四種型別的疫苗常發生較嚴重的副作用。
(2)競爭性干擾現象:不同型別病毒的抗體產生速度不同,出現競爭性干擾現象,使產生的抗體以第三型登革熱為主。
在台灣也有相當多的學者專家積極參與疫苗研發,高雄榮總醫師黃永豐等人的研究,是利用非結構性病毒蛋白,以基因工程方式製造疫苗,但仍未進入人體試驗階段。
登革熱病毒與疫苗 (Dengue Fever)-中
登革熱病毒與疫苗 (Dengue Fever)-中
國立苗栗高級中學生物科郭美貞老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
細胞素是發炎反應的重要訊號分子,可調控多種白血球的活化;白血球表面具有細胞素受體,藉由受體與細胞素的結合,獲得發動攻擊訊號。
若巨噬細胞沒有成功吞噬登革病毒,病毒便會與巨噬細胞表面的受體結合,並誘發巨噬細胞分泌過量的細胞素,引起嚴重發炎反應,導致登革出血熱(Dengue Hemorrhagic Fever)與登革熱休克症候群(Dengue Shock Syndrome),其致死率可高達四至五成,這也是登革熱之所以危險的原因。
目前還沒有登革熱的特效藥及疫苗,對於登革熱伴隨的出血及休克,只能提供水份及電解質,以維持患者生命。不過,最近由陽明大學微生物暨免疫學研究所教授謝世良領導的研究團隊,提出一種新的抗病毒策略,為成功治療登革熱併發症帶來一線希望。
研究團隊發現,登革病毒會和巨噬細胞的CLEC5A受體結合,刺激巨噬細胞分泌大量細胞素,因此研究人員利用CLEC5A的拮抗性抗體及阻擾性RNA,成功阻斷CLEC5A受體與登革病毒結合,有效抑制登革熱病毒引發的血管及血漿滲漏,同時預防發炎反應,並保有免疫系統對抗病毒的能力。
未來還要透過基因工程純化出人體的CLEC5A抗體,才能發展成藥物,進行人體試驗。若真的順利研製成功,登革病毒引發的出血性登革熱將不再對人類構成威脅了。
- 1
- 2

.jpg)