化學變化
化學變化 (Chemical Change)
國立泰山高級中學化學科邱大育老師/國立臺灣師範大學化學系葉名倉教授責任編輯
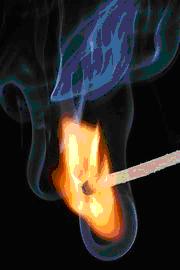
燃燒是化學變化的一個例子。
化學反應是反應物變成一個或多個不同產物的過程,當化合物形成或分解即發生化學變化。在反應的期間,原子間重新排列而形成或打斷化學鍵。
簡單的說,當一個物質改變成另一個物質時即發生化學變化(即形成一種新物質)。而無產生新物質即為物理變化(例如,熔化冰是物理變化,因為當冰變成水,沒有產生新物質;鹽溶於水中也是物理變化,因為鹽水仍是鹽和水。)
有幾不同的類型化學變化。包括合成、分解、單取代、雙取代、中和、沈澱和氧化還原。