化學反應原理
反應式、化學反應式平衡、化學動力學、催化反應
硝化反應(Nitration)
質量守恒(Conservation of Mass)
質量守恒(Conservation of Mass)
台北市立永春高級中學化學科蔡曉信老師/國立台灣師範大學化學系葉名倉教授責任編輯
質量守恒或物質不滅定律(The law of conservation of mass/matter)又稱落蒙諾索-拉瓦節定律(Lomonosov-Lavoisier law):說明在密閉系統中質量保持定值與系統內的反應過程無關。換句話說物質不能被生成與破壞,只會進行重組的反應。這意味著在密閉系中的化學反應其反應物的總質量必等於生成物的總質量。在狹義相對論與量子力學提出前,質量守恒定律能說明一般古典物理的現象。這個有歷史性的概念廣泛應用在許多科學領域上,如:化學、力學及流體力學。
歷史的發展與重要性
在西元13世紀時Nasīr al-Dīn al-Tūsī 已提出質量守恒定律初步但不完整的概念,他認為物質能改變但不會消失。到了1789年拉瓦節首先有系統且清楚地提出質量守恒定律,因此拉瓦節被譽為近代化學之父。然而早在1748年Mikhail Lomonosov就已表達出相同的想法並已得到實驗的應證。
反應速率(Reaction Rate)
反應速率(Reaction Rate)
台北市立第一女子高級中學二禮3號婕,二禮 40號 鄭佳怡/台北市立第一女子高級中學化學科周芳妃老師修改/國立台灣師範大學化學系葉名倉教授責任編輯
對特定反應而言,反應速率(reaction rate)的定義是單位時間內反應物或產物生成的快慢。研究反應速率的理論屬於化學動力論(Chemical kinetics),這些化學動力論的觀念用在許多領域,像是:化學工程學、酵素學、和環境工程學等。影響反應速率的因素很多:物質本性、溫度、濃度、壓力、固體顆粒總表面積、催化劑、溶劑種類、電磁波、同位素、試劑添加順序及攪拌等,分別簡介如下: (1) 物質本性 某些反應本質上就比其他來的迅速,舉例而言,在空氣中鐵的氧化,是長達數年的緩慢反應,但是丁烷的燃燒卻只需要數秒的時間。依據碰撞學說(collision theory),活化能愈高的系統,其反應速率愈慢。 (2) 溫度 依據碰撞學說,通常在較高溫下進行反應,透過增加分子的碰撞,可以使反應速率提高。然而主要的原因,是因為碰撞的分子擁有比較高的能量,而導致有效碰撞的增加,也就是說原子間的化學鍵較易被打斷和生成。溫度的影響在阿瑞尼士方程式(Arrhenius equation)裡有被提及,一般而言,溫度每上升10℃,反應速率會增為2~3倍。 (3) 濃度、壓力及固體顆粒總表面積。
化學中的裂解(cracking)
化學中的裂解(cracking)
國立台灣師範大學化學系葉名倉教授責任編輯
在石油地質學和化學中,裂解是藉著打斷前驅物的碳-碳鍵,將複雜的有機分子(例如油母或較大的碳氫化合物)斷裂成較小分子的程序。而溫度和催化劑則對於裂解反應的反應速率和最後生成的產物有很大的影響。裂解也常被稱為熱裂解,將大分子烷類斷裂為應用性較大的小分子烷類及烯類。
催化劑裂解
催化劑裂解利用沸石催化劑和適度的高溫(400-500 °C)來將大分子碳氫化合物斷裂成較小的分子。在反應過程中,反應性較小(也就是較穩定、存在較久)的陽離子中間物會堆積在催化劑的活化位置上,產生含碳產物的沉積(也就是焦炭)。這些沉積物必須被移除(通常利用燃燒),以恢復催化劑的活性。
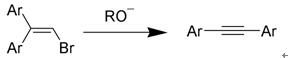
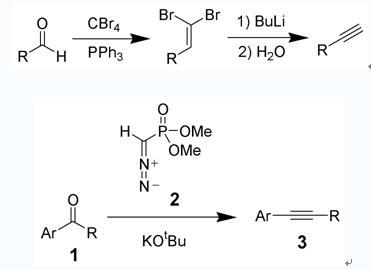
炔類的合成與反應(the synthesis and reaction of alkyne)
催化劑(catalyst)
催化劑(catalyst)
台灣師範大學化學系葉名倉教授責任編輯
在化學反應中,不是反應物也不是生成物,但是卻參與了反應的過程,並且可以改變化學反應速率的物質,稱為催化劑(catalyst)。工業上將催化劑又稱為觸媒,在生化反應中的催化劑則稱為酶(enzyme)。催化劑在反應完成後,本身質量既不增加,也不減少。催化劑可以多次使用於催化相同的反應,也就是說,催化劑具有很高的專一性。
催化反應的途徑都是會經過多重步驟,在某個步驟中催化劑又會被重新釋放出來。這些多重步驟也都伴隨生成一些中間產物(intermediate product),在某個步驟中中間產物又會被消耗而消失。例如下列一連串的反應步驟(1)~(4):
(1) A + C → AC
(2) B + AC → ABC
(3) ABC → CD
(4) CD → C + D
其中A和B是反應物,C是催化劑,D是產物,中間產物包含了AC、ABC以及CD。
反應步驟(1)~(4)最終的淨反應為: A + B → D 依據碰撞學說解釋反應速率的說法,催化劑因可藉著改變反應的路徑,而降低原反應的活化能,使反應物能量能夠超越活化能(低限能)的粒子數增加,造成有效碰撞分率更高,而使反應速率變快。
催化反應(catalysis reaction)
催化反應(catalysis reaction)
台灣師範大學化學系葉名倉教授責任編輯
催化劑(catalyst)是一種能夠加快反應速率的物質,其可使反應以較低活化能(activation energy)路徑來進行,這種作用稱為催化反應(catalysis reaction)。催化劑會與反應物發生作用,它們有可能會在反應某階段中被消耗,然後在整個反應結束之前又重新產生。大多數催化劑都只能加速某一種化學反應,而不能被用來加速所有的化學反應。
催化劑通常被分成三種類型: (1) 均相催化劑(homogeneous catalyst):又稱單相催化作用。均相催化劑與反應物為同一種相。例如:當四氧化二氮(N2O4)在日光下可被氯氣(Cl2)催化分解成氮氣(N2)和氧氣(O2),此處氯氣就是均相催化劑。 (2) 非均相催化劑(heterogeneous catalyst):又稱異相催化劑或觸媒,催化劑與反應物為不同的相。在非均相催化反應中,反應物先吸附(adsorption)在催化劑表面,接著反應物結構內原有的化學鍵斷裂並有新鍵產生,最後產物從催化劑表面脫附(desorption)離開。例如:生產人造奶油(氫化油)時,反應物是液態植物油和氣態氫氣,非均相催化劑則是固態鎳。 (3) 生物催化劑(biocatalysts),又稱酵素或酶(enzyme)。酶是蛋白質,屬於聚合物高分子。擔任反應物的受質通常在酶表面特定位置的活性中心(active site)進行催化作用,生物體利用酶們來加速體內的化學反應,而此酶需要適合的溫度方能作用。
沉澱(precipitation)
沉澱(precipitation)
台灣師範大學化學系葉名倉教授責任編輯
在化學領域中沉澱作用(precipitation)的過程是從反應的液相系統中產生一個可分離的固相,或是從過飽和溶液(supersaturation)中析出難溶性的固體。產生沉澱的化學反應又稱為沈澱反應(precipitation reaction)。