氮氧化物(Nitrogen Oxides)
氮氧化物(Nitrogen Oxides)
臺北市立第一女子高級中學二年級吳其錡
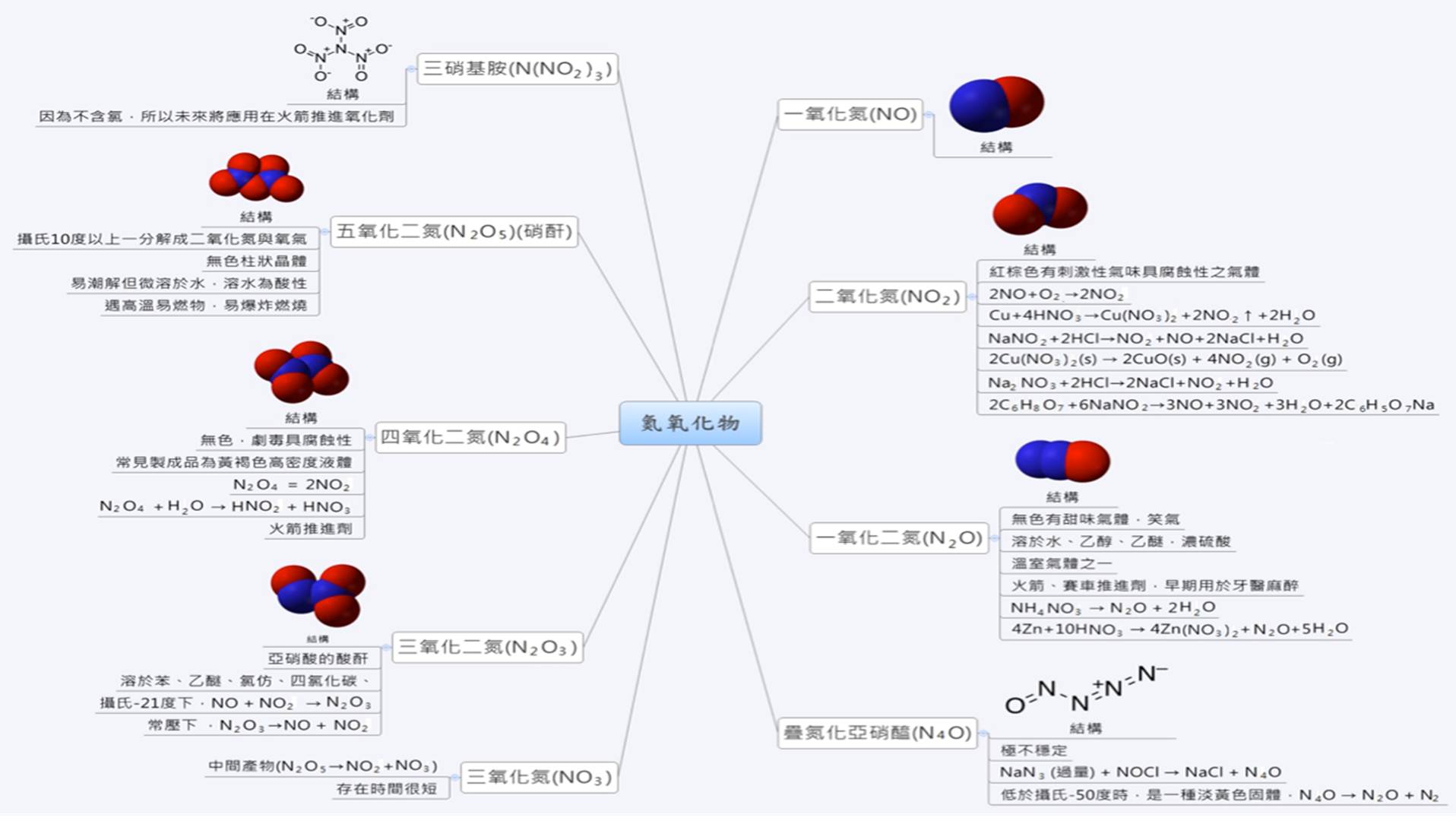
氮氧化物多為有毒物。其中有些是酸酐,遇水可以生成硝酸、亞硝酸等酸類。分子結構以及常見的製備方法整理於下圖:
一氧化氮(NO)
無色無臭氣體,自然界不常見,極不穩定,在常溫常壓下為腐蝕性氣體,容易氧化形成紅棕色的二氧化氮,反應式為:2NO+O2→2NO2
一氧化氮製備反應:
N2 + O2 → 2 NO (氮氣與氧氣經閃電或高溫後產生大氣中天然的一氧化氮)
4 NH3 + 5 O2 → 4 NO + 6 H2O
8 HNO3 + 3 Cu → 3 Cu(NO3)2 + 4 H2O + 2 NO
2 NaNO2 + 2 NaI + 2 H2SO4 → I2 + 4 NaHSO4 + 2 NO
2 NaNO2 + 2 FeSO4 + 3 H2SO4 → Fe2(SO4)3 + 2 NaHSO4 + 2 H2O + 2 NO
3 KNO2 (l) + KNO3 (l) + Cr2O3(s) → 2 K2CrO4(s) + 4 NO (g)
二氧化氮(NO2)
紅棕色有刺激氣味且具腐蝕性氣體,經光分解後生成對流層中的臭氧,有害人體。
二氧化氮製備反應:
2NO+O2→2NO2
Cu+HNO3→Cu(NO3)2+NO2↑
NaNO2+2HCl→NO2+NO+2NaCl+H2O
2Cu(NO3)2(s)→2CuO(s) + 4NO2(g) + O2(g)
NaNO3+2HCl→2NaCl+NO2+H2O
2C6H8O7+6NaNO2→3NO+3NO2+3H2O+2C6H5O7Na
一氧化二氮(N2O)
無色有甜味氣體,又名笑氣,有輕微麻醉作用。化學性質穩定。可溶於水、乙醇、乙醚、濃硫酸,也是溫室氣體之一。早期用於牙醫麻醉劑,現今用於火箭、賽車推進劑。
一氧化二氮製備反應:
NH4NO3→N2O + 2H2O
4Zn+10HNO3→4Zn(NO3)2+N2O+5H2O
疊氮化亞硝醯(N4O)
此氮氧化物極不穩定,低於-50℃時,是一種淡黃色固體,很容易分解變成一氧化二氮與氮氣,反應式為:N4O → N2O + N2
疊氮化亞硝醯製備反應:
NaN3 (過量) + NOCl → NaCl + N4O
三氧化氮(NO3)
此氮氧化物極不穩定,屬於五氧化氮分解反應的中間產物(N2O5→NO2+NO3) ,也會破壞臭氧層。
三氧化二氮(N2O3)
亞硝酸的酸酐,為紅棕色氣體,溶於苯、乙醚、氯仿、四氯化碳等。三氧化二氮很容易分解為一氧化氮與二氧化氮,反應式為:N2O3→NO + NO2
三氧化二氮製備反應:
在-21℃下,NO + NO2→N2O3
四氧化二氮(N2O4)
無色氣體,劇毒具腐蝕性,常見製成品為黃褐色高密度液體,做為火箭推進劑。高溫時,四氧化二氮很容易分解產生二氧化氮。反應式為:N2O4→2NO2。四氧化二氮溶於水會產生硝酸與亞硝酸,反應式為:N2O4+ H2O→HNO2 + HNO3。
五氧化二氮(N2O5)
無色柱狀晶體,化學性質非常不穩定,室溫時易分解成二氧化氮與氧氣。
三硝基氨(N(NO2)3)
最晚發現的氮氧化物, 2010年由瑞典皇家工學院研究者發現,將應用在火箭推進氧化劑。
參考資料:
1. http://www.webelements.com/compounds/nitrogen/nitrogen_monoxide.html
2. http://en.wikipedia.org/wiki/File:Nitric_oxide_production.png
3. http://zh.wikipedia.org/wiki/%E6%B0%AE%E6%B0%A7%E5%8C%96%E7%89%A9
4. http://140.122.143.143/NSC/bionetwork/biorelative/NO.html


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 
