熱力學第三定律
熱力學第三定律 (Third law of thermodynamics)
國立臺灣大學物理系101級 鍾豪
第三定律是描述一個系統在接近絕對零度時的行為。隨著熱力學的發展,第三定律有不同的描述,但在適當的條件下這些描述彼此都是等價的。
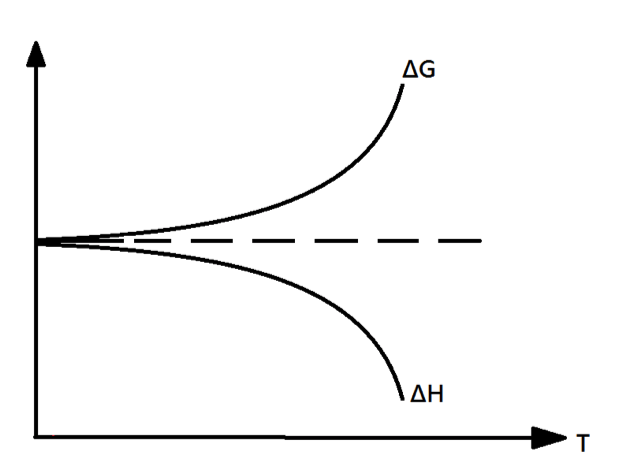
理查德茲(Theodore William Richards)在1902年進行電化學電池的實驗及整理相關數據時,發現焓(enthalpy, \(H\))的變化量和吉布斯自由能(Gibbs free energy, \(G\))的變化量在接近絕對零度時,彼此趨近,也就是當 \(T\rightarrow 0\),\(\Delta G\rightarrow \Delta H\),如圖一。
但他似乎並未體認出此現象的意義。這重要的一步之後係由能斯特(Walter H. Nernst)首度跨出。根據熱力學關係:\(G\equiv H-TS\),其中 \(S\) 為熵(entropy),可推導出 \(\Delta G=\Delta H-T\Delta S\)。
因為兩者的變化量以漸近線的方式趨近,所以能斯特認為絕對零度附近時,熵值的變化量也應趨於零,也就是當 \(T\rightarrow 0\),\(\Delta S\rightarrow 0\)。所以能斯特在1906年時提出:「接近絕對零度時,所有在熱平衡時發生的反應,熵值變化為零。」以數學式表示為:\(\lim_{T\rightarrow 0}(S_1-S_2)=0\)。
1911年,普朗克(Max Planck)進一步提出:「任何系統在絕對零度達熱平衡時,該系統的熵值為零。」這便是熱力學第三定律的其中一個詮釋。在這之前,人們只能得知熵值的變化量,無法對於一個系統在特定溫度時,給予一個絕對的熵值。第三定律一旦成立,則自動保證系統在絕對零度時的熵為零,由此便能推出任何溫度下絕對的熵值,於是人們便可以從原理上去決定出許多化學平衡反應的重要化學量(例如平衡常數)。
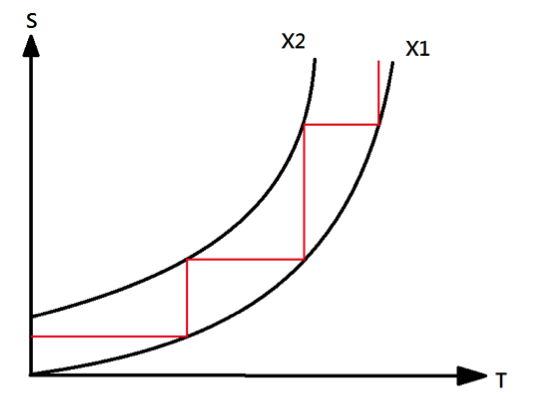
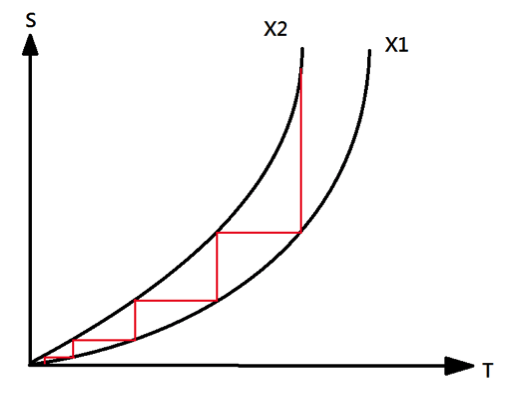
由能斯特和普朗克對第三定律的描述可推導出「不可能在有限步數中,將一個系統的溫度降至絕對零度。」換言之,絕對零度無法達到。假想有兩個系統 \(X_1\) 和 \(X_2\),在溫度趨於零時,兩者的熵值並無同樣趨於零(如圖二)。則我們可藉由有限個等溫過程(如圖中鉛直紅線)和有限個等熵過程(也就是絕熱過程,如圖中水平紅線),將系統降至絕對零度。但根據熱力學第三定律,所有系統在絕對零度時,熵值為零,故X1和X2兩系統的熵值在絕對零度時會交於一點(如圖三),而圖2的系統不存在。如此一來,卻就需要無限個等溫過程和等熵過程才能達到兩系統的交點。但真實世界中,無限次的過程無法達到,故絕對零度無法達到。由於任何真實過程可視為等溫過程和等熵過程的過程組合,故以上推論並無喪失一般性。
熱力學第三定律能推導出許多重要的結果,物體的熱容量便是其中之一。
由熵的定義得知:\(T\mathrm{d}S=\mathrm{d}Q=\frac{\mathrm{d}Q}{\mathrm{d}T}\times\mathrm{d}T=C\times\mathrm{d} T\),
其中 \(C\) 代表熱容量,\(\Delta Q\) 代表反應前後系統總能量的變化。
\(\int\mathrm{d} S=S-S_0=\int_0^T C\frac{\mathrm{d}T}{T}\)
又根據第三定律,接近絕對零度時熵值變化量為零,
\(\lim_{T\rightarrow 0}(S-S_0)=\lim_{T\rightarrow 0}\int_0^TC\frac{\mathrm{d}T}{T}=0\),
故熱容量 \(C\) 需比 \(1/T\) 在接近絕對零度時更快收斂。
因此任何物質的熱容量 \(C\) 在接近絕對零度時都趨於零。
參考文獻
- Carter A. H.(2001), Classical and statistical thermodynamics, Prentice Hall.
- Blundell S. J., Blundell K. M.(2009), Concepts in Thermal Physics, 2th, Oxford.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] 2016春季展望─天文宇宙大發現](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/03/lec.png) [講座] 2016春季展望─天文宇宙大發現
[講座] 2016春季展望─天文宇宙大發現 ![[影音] 大師講座:楊振寧《美與物理學》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/02/yang_banner_620x280.jpg) [影音] 大師講座:楊振寧《美與物理學》
[影音] 大師講座:楊振寧《美與物理學》  維恩位移定律
維恩位移定律 ![[講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/110600223.png) [講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險
[講座] CASE電影講座:百年熒惑說分明 ─ 從「絕地救援」談太空探險 ![[講座] [探索基礎科學系列講座14]一方程式見宇宙](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/09/sp_ex14.png) [講座] [探索基礎科學系列講座14]一方程式見宇宙
[講座] [探索基礎科學系列講座14]一方程式見宇宙  玻色-愛因斯坦分布
玻色-愛因斯坦分布  過阻尼, 欠阻尼, 臨界阻尼
過阻尼, 欠阻尼, 臨界阻尼  【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象
【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象 
