反應熱
彈卡計(Bomb calorimeter)
彈卡計(Bomb calorimeter)
國立臺灣大學化學工程系碩士生吳宗澤/國立臺灣大學化學系陳藹然博士責任編輯
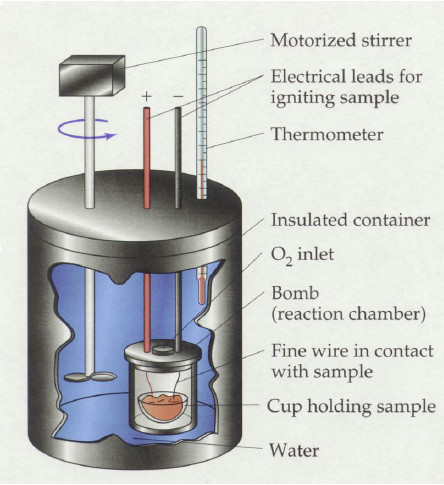
彈卡計(Bomb calorimeter)是一種定體積的卡計(Calorimeter),用來測量反應的燃燒熱(Heat of combustion)。一般彈卡計的裝置如下圖所示:
彈卡計為一不鏽鋼製反應容器,內有一不鏽鋼製的高壓罐,這是因為燃燒反應前後系統體積不變,導致使系統壓力變大,故需要在能耐高壓的反應槽內進行,反應物 放置於高壓罐中的樣品杯內。將秤好重量的反應物放入樣品杯中之後,小心密封住,並且在樣品杯內填充純氧。填充純氧的原因是為了確保燃燒時有足夠的氧氣供應 使反應物可以燃燒完全;如果燃燒不完全,則會有部分的試料並沒有成功燃燒,那麼所求得的數據是完全不準的。完成氧氣的填充之後,將高壓罐放入反應容器中, 在反應容器內加入一定量的水,接上溫度計,點火線,攪拌棒等等,將反應容器放於絕熱環境內避免反應中系統和大氣進行熱交換,就完成了以彈卡計測量燃燒熱的 準備步驟。
赫斯定律
赫斯定律 (Hess law)
國立中山大學董騰元教授責任編輯
Hess law就是俄國的化學家 Germain Henri Hess(1802年8月7日〜1850年11月30日),依其在熱化學方面的研究結果,於1840年,所提出的一個概念:在熱化學上,一個化學反應熱含量-焓 (enthalpy) 的變化,是可以預測,其值與反應途徑無關。
Hess law指出焓 (enthalpy) 是狀態函數 (state function),一個化學反應焓的變化量是固定的,與反應途徑無關。換句話說,只與反應前的狀態和反應後的狀態有關,與反應經由的路徑無關。因此若一個化學反應的熱含量變化 (△H),無法直接測得時,便可以藉由這個定律計算出。