
暖暖包的原理
暖暖包的原理
國立臺灣大學大氣科學所碩士生謝璨筑
市面上暖暖包的種類大致分為兩種,一種是鐵粉及食鹽製作的一次性暖暖包,顧名思義就是用過一次後就無法再利用了。它的發熱原理是鐵粉經搓揉之後,與空氣中的氧氣進行氧化作用,鐵粉經氧化生鏽而放出熱量,但鐵在有水時才容易進行放熱反應,所以通常會加入食鹽等容易吸收空氣中水分的物質使反應易於進行,達到保暖效果。
另外一種暖暖包的發熱機制是利用醋酸鈉在水裡面溶解度的特性。這種暖暖包中的醋酸鈉水溶液原是處於過冷(過飽和)狀態,暖暖包中有一小鐵片,當有外力按壓此小鐵片產生微小震動,過冷(過飽和)的醋酸鈉水溶液受到擾動,開始從不穩定狀態趨向穩定狀態,此時醋酸鈉開始結晶並釋放潛熱,暖暖包發揮其功效。
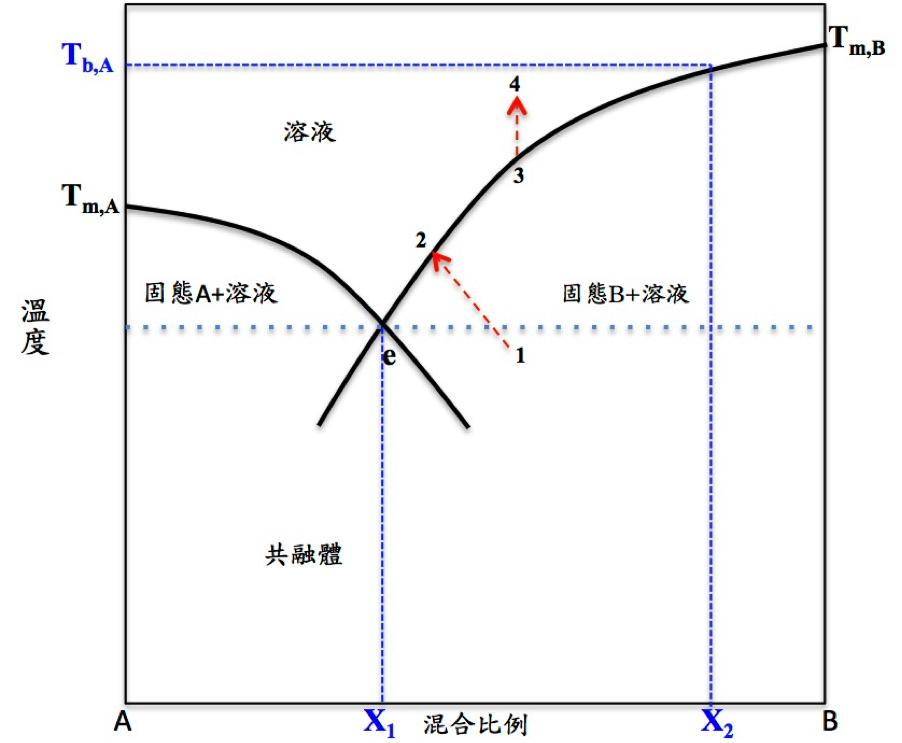
由理想的醋酸鈉與水的 T-C phase diagram(圖一)可簡單解釋此種暖暖包的發熱原理。T-C phase diagram 為 A、B 兩物質混合後,因其混合比例不同而影響融點的圖。
A 物質的融點會因為加入了 B 物質,受溶質效應之影響,使 A 物質的融點下降;同樣地,B 物質的融點也會因加入 A 物質,使 B 物質的融點下降。當 A 和 B 混合到某個比例時,A 和 B 會有相同的融點,該點稱為共融點 \((e)\)。
假設 A 為純水,B 為醋酸鈉,A 和 B 混合後為醋酸鈉水溶液。共融點的重要性在於,此點是醋酸鈉水溶液能夠維持在液態的最低溫度。在熱力平衡下,低於此溫度時,純水和醋酸鈉都會變成固態。若熱力不平衡,低於此溫度時,則可能會有過冷現象發生。
如圖一所示,醋酸鈉水溶液一開始為過冷(過飽和)狀態 \((1)\),按一下裡面的鐵片是刺激它核化,固體會出來,放出潛熱,溫度會往上升 \((1\to 2)\)。假使裡面的液體全部變成固體 \((2\to 3)\),濃度最多只會回到最初的濃度。此時若要將暖暖包裡的固體全部變成液體,必須加熱將其溫度升高。
加熱的方式有很多種,但此種暖暖包不可直接加熱,因為直接在火上加熱會燒掉。通常使用隔水加熱,使暖暖包裡面的固態物質融化變成液態,而加熱溫度也有所限制,不能加熱超過水的沸點,亦即加熱溫度最高只能夠在水的沸點以下。由 \(3\to 4\) 即可將固態物質全部變成液態,靜置一段時間後,醋酸鈉水溶液又會回到過冷狀態。因此,可利用此圖來調配液體的初始濃度。假設水的沸點在 \(T_{b,A}\),調配的濃度要介於 \(X_1\) 和 \(X_2\) 之間。
另外有些延伸的問題,例如:為何要用醋酸鈉作為暖暖包的材料呢?第一,醋酸鈉相較其他化學物質要來的安全。第二,醋酸鈉是少數可以在室溫下有過冷狀態的物質。暖暖包發熱原理還有許多有趣的現象,例如:為何按壓鐵片可以幫助核化(從液態變固態)?因為按壓鐵片之後,造成液體振動並改變水溶液密度,而密度的改變相當於在一個局部的地方給它一點點的能量,讓它突破核化的能量障礙。
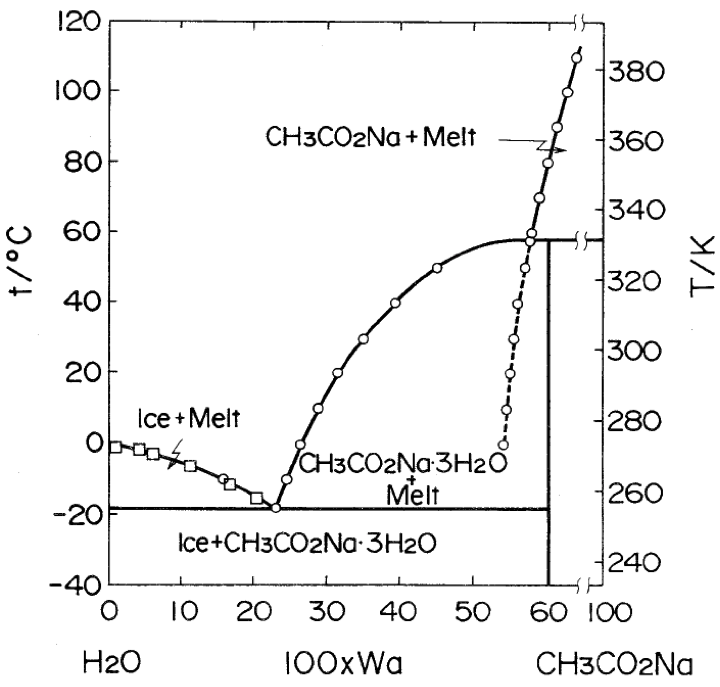
有時候會在暖暖包裡看到一些沈澱物,這跟實際醋酸鈉與水的 T-C phase diagram 有關(圖二)。看到的沈澱物應該是醋酸鈉水合物 \((\mathrm{CH_3CO_2Na\cdot 3H_2O})\),水合物出來之後,剩下的溶液裡面是真正濃度較高的醋酸鈉水溶液,該溶液還是處於一個過冷(過飽和)狀態。醋酸鈉水合物其實對純的醋酸鈉析出並沒有太大的幫助,因為這兩個固態的結構有所差異,因此純的醋酸鈉無法有效地在醋酸鈉水合物上面成長。
參考資料
- 大氣物理化學第二章講義 [作者:陳正平老師]
- Studies on sodium acetate trihydrate for latent heat storage [作者:Takahiro Wada, 1985]
- http://case.ntu.edu.tw/magichem/blog/?p=965 化學小知識-醋酸鈉暖暖包-國立台灣大學科學教育發展中心
- http://waknow.com/?p=5828 [知識分享] 抵抗寒冬,暖暖包原理知多少 | Waknow我懂


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 2016年的天文大小事
2016年的天文大小事  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【極端氣候系列報導】(一):屢創新高的地表溫度
【極端氣候系列報導】(一):屢創新高的地表溫度 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 
