彈卡計(Bomb calorimeter)
彈卡計(Bomb calorimeter)
國立臺灣大學化學工程系碩士生吳宗澤/國立臺灣大學化學系陳藹然博士責任編輯
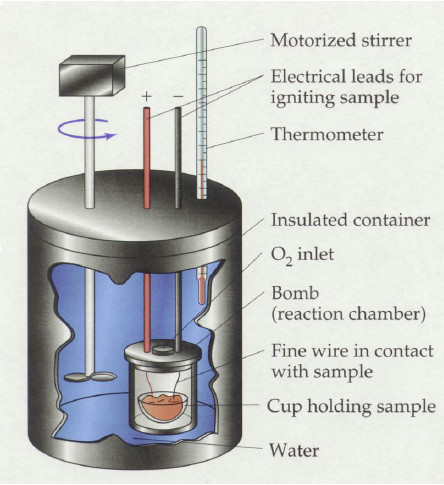
彈卡計(Bomb calorimeter)是一種定體積的卡計(Calorimeter),用來測量反應的燃燒熱(Heat of combustion)。一般彈卡計的裝置如下圖所示:
彈卡計為一不鏽鋼製反應容器,內有一不鏽鋼製的高壓罐,這是因為燃燒反應前後系統體積不變,導致使系統壓力變大,故需要在能耐高壓的反應槽內進行,反應物 放置於高壓罐中的樣品杯內。將秤好重量的反應物放入樣品杯中之後,小心密封住,並且在樣品杯內填充純氧。填充純氧的原因是為了確保燃燒時有足夠的氧氣供應 使反應物可以燃燒完全;如果燃燒不完全,則會有部分的試料並沒有成功燃燒,那麼所求得的數據是完全不準的。完成氧氣的填充之後,將高壓罐放入反應容器中, 在反應容器內加入一定量的水,接上溫度計,點火線,攪拌棒等等,將反應容器放於絕熱環境內避免反應中系統和大氣進行熱交換,就完成了以彈卡計測量燃燒熱的 準備步驟。
點火方式則是通入電流,點火線在通入電流後就會產生高溫,使得試料產生反應燃燒,燃燒時所放出的熱則會被周圍的水吸收,如此一來可藉由溫度計測得的溫度變化,已知加入容器中的水量,就可以求出該反應物燃燒所放出的熱量,算得其燃燒熱。
在使用彈卡計求出燃燒熱之後,需要考慮因為利用點火所產生熱量誤差,必須扣除掉電流引發點火的熱量。校正的方式可藉由燃燒一定量已經知道其燃燒熱的物質,此計算彈卡計內水溫上升所吸收的熱量會等於該物質燃燒熱在電流引發點火的熱量。
彈卡計的原理為:反應物燃燒放熱,使彈卡計內的水溫度上升ΔT,則反應放出熱量
Q = 彈卡計的熱容量ΔT + 水的熱容量*ΔT
=彈卡計的熱容量ΔT + 水的比熱*水的重量*ΔT
根據熱力學第一定律 ΔU= q + w
由於燃燒於定容之卡計中進行,系統內的內能變化為
ΔU = q + w = q = qv
即能量變化等於熱。
又ΔH =ΔU+Δ(PV) = ΔU +ΔPV
因為對所有反應物以及產物均為固體或液體的反應來說,在定壓下,其反應前後的體積變化非常非常的小,換算成在一大氣壓之下,Δ(PV)=1 (J mol-1),相較於動輒上千焦耳的反應熱來說,Δ(PV)的值實在是非常的小,因此當反應物及產物皆為固態或液態時,其ΔH約略等於ΔU。故測得的熱量(Q)變化視為燃燒熱(ΔH)。
參考資料:
1. 林振隆譯,物理化學 physical chemistry,第82-85頁。
2. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; pp. 367-368.
3. WIKIPEDIA– Calorimeter http://en.wikipedia.org/wiki/Calorimeter


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義 

不銹鋼容器會不會將熱導走?
還有半液體(如果凍)可以測嗎?
可否用電湯匙?