1~20號元素原子的核外電子組態與元素的性質
1~20號元素原子的核外電子組態與元素的性質(Electron Configuration and The Characters of Element No.1~ No.20)
臺北縣私立淡江高級中學化學科賴亭吟老師/國立臺灣大學化學系陳藹然博士責任編輯
原子由質子、中子和電子組成,原子和中子組成了原子核,電子則圍繞在原子核的四周,但是如何去描述電子的行為,一直是對科學家的一大挑戰。電子是很特別的微小粒子,海森堡(Werner Heisenberg, 1901-1976)告訴我們像這麼小的粒子是具有波動性的,也就是說電子既是粒子也是波,兼具粒子與波動兩種性質。
1926年奧地利科學家薛丁格(Erwin Schrodinger, 1877-1961)發展出量子力學(Quantum mechanics),以數學的方程式解釋了原子中電子在哪裡。從方程式裡,薛丁格用了三個參數來描述原子中電子的位置,這三個參數分別是「主量子數(The Principle quantum number, n)」、「角動量子數(The azimuthal quantum number, l)」與「磁量子數(The magnetic quantum number, ml)」。不過這並不代表電子是固定在特定的位置上,實際上電子就像一個愛玩躲貓貓的小孩,他不會一直出現某個地方,而是跑來跑去的,所以科學家只能算出他最可能出現的地方,以「機率」來描述電子的位置。
主量子數n為正整數,代表電子跟原子核的平均相對距離,n值越大離原子核越遠。角動量子數l描述了電子佔據區域的形狀,值和n有關。還有一個磁量子數ml,磁量子數則是決定電子佔據區域的方位,且受外加磁場影響,值和l有關。用這三個量子數的排列組合足以描述每個電子在原子中的空間分布,而電子在原子中的空間分布稱為「軌域(Orbital)」。因為主量子數決定電子和原子核的平均距離,相同主量子數的軌域和原子核距離相似,形成一殼層(Principal shell),依電子距原子核遠近,由內而外可以主殼層n=1、2、3、4…表示,對應代號分別為K、L、M、N…層。而相同主量子數和角動量子數的軌域組成次殼層(Subshell)。
每一軌域的電子都具有特定能量,越靠近原子核,能量越低;距原子核越遠,能量越大。能量由低到高如同階梯,稱為「能階」。電子填入殼層時,須由低能階殼層開始,依序往高能階殼層填入。每一個殼層最多可填入2n2個電子,填滿後即往能量較高的下一層填入。因此主殼層n=1(K層)可容納2個電子,n=2(L層)可容納8個電子,n=3(M層)可容納18個電子…。 週期表中原子序1~20號元素的電子組態如下圖:
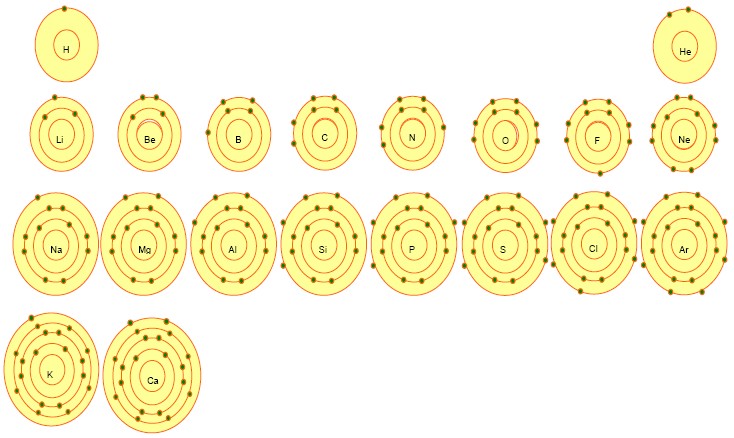
電子填入之最外殼層稱為價殼層(Valence shell),價殼層中的電子稱為價電子(Valence electron)。價電子的數目影響元素之化學性質,因此有相同價電子數的元素,就可能有相似的化學性質。在週期表中,橫列為週期,擁有相同主量子數的元素在同一週期。直行為族,擁有相同價電子數的元素在同一族。IA族 包含鋰(Li)、鈉(Na)、鉀(K),價電子數皆為1,都是灰色,是質軟且活性大的金屬,因為其金屬氧化物為鹼性通稱鹼金屬。VII A族包含氟(F)、氯(Cl),價電子數皆為7,皆為有顏色,氧化力強的氣體,通稱為鹵素。VIII A族包含氦(He)、氖(Ne)、氬(Ar),除氦的價電子數為2,其餘價電子數皆為8,是該殼層價電子數最多的元素,因此特別安定,不易發生反應,在自然界多以單原子的形式存在,又稱惰性氣體或鈍氣。
在週期表中,對於同族元素,由上至下電子殼層數增加,原子半徑越大,原子核對最外層電子的吸引力越小,因此最外層電子越容易失去,即金屬性越強。對於同週期元素,越往右核電荷數增加,原子核對外層電子的吸引力越強,原子半徑逐漸減小,非金屬性越強。介在金屬和非金屬之間為類金屬,如硼(B)、矽(Si)…等,其導電度也藉在金屬與非金屬之間,為製成半導體的材料。
參考資料
1. 陳竹亭教授主編,《基礎化學》,第46頁至第47頁,泰宇出版社,2010年1月初版。
2.〈09-原子結構與周期表〉,教育部學習加油站網站–學科教材-高中-化學。
http://content.edu.tw/senior/che … number3/1/index.htm
3.〈原子的核外電子排列規律〉,百度-知道網站,2006年3月25日。
http://zhidao.baidu.com/question … cid=197&index=1


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  化學傳記:法拉第不為人知的一面(十一):凡人法拉第
化學傳記:法拉第不為人知的一面(十一):凡人法拉第  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名 
