合金(二)─ 合金的結構
合金(Alloys)(二)─ 合金的結構
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
合金(Alloys)是含金屬的混合物,是溶液的一種,較少量的元素視為溶質,主成份金屬為溶劑。根據組成結構可分為:取代合金(Substitutional alloy)與填隙式合金或插入式合金(Interstitial alloy)。
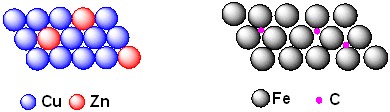
合金的結構比純金屬複雜,因為組成元素大小混雜,各有各的原子半徑。當混合成合金的原子大小相近的時候,如皆為過渡金屬元素(d-block),其中主成份金屬晶格中的金屬原子可以被另外一種金屬原子所替換,例如銅的原子半徑和鋅幾乎相同且兩者電子性質相似,銅原子可以被鋅所取代,這種合金稱為取代合金,例如黃銅(Brass)為1/3的鋅加上2/3的銅,而英幣標準銀(Sterling silver)則是93%銀混合7%銅。
雖然形成合金的成份金屬彼此的原子半徑差距不超過15%,且電子性質相近,但是這種原子的替換還是會對其主成份的晶體結構(晶格)產生些微影響,阻礙金屬內電子的流動,造成導電度(Electrical conductivity)與導熱率(Thermal conductivity)降低。也由於合金中金屬晶格產生擾動,晶面反而比較難以移動,因此取代合金的強度都比純主成份金屬高。
取代合金的軟硬度和熔點受到成份金屬元素原子大小影響。鉍(Bismuth)可以軟化金屬並降低金屬的熔點,因為鉍是較大的原子,加入一般的主成份金屬後會撐大結構,就像把一顆顆哈密瓜大小的粒子填入原本由橘子般大小原子組成的結構中,結構變得較為鬆散,金屬固體的硬度和熔點因而下降。
當形成合金的成份原子大小相差很遠的時候,即兩者原子半徑差距超過60%時,較小的元素(溶質)可以進入較大原子(溶劑/主成份金屬)形成緊密堆積晶體的空隙中,這種合金稱為「填隙式合金」。因為兩者原子半徑差距大,大致上的主成份金屬晶體架構沒有改變,但是填入另一種元素後卻會造成金屬性質出現很大的改變。例如鋼(Steel)是碳和鐵形成的合金,小顆的碳原子填入鐵的晶格中,將原本較軟且具延展性的鐵變成堅硬的鋼。合金硬度的改變可以用成份原子間的鍵結來解釋。
純的鐵金屬中,鐵原子和鐵原子之間的鍵結不具方向性,鐵原子在鐵金屬裡可以很容易相互錯動換位,所以鐵金屬柔軟易變形。當碳原子加到鐵金屬中,碳原子和鐵形成碳-鐵鍵,碳-鐵鍵具有方向性,故碳鐵合金硬度、強度大增。填隙式合金的插入元素原子同樣會干擾金屬內電子的流動,造成導電度與導熱率降低,並抑制主成份金屬在晶格中的移動,導致合金的強度都比純主成份金屬高。
參考資料:
1. Akins, P.; Jones, L. Chemical Principles – The Guest for Insight, 4th edition; W. H. Freeman and Company: New York, 2008; p. 202-203, 692.
2. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 784-785.
3. Wikipedia– Alloys http://en.wikipedia.org/wiki/Alloys


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係
化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚 
