玻璃(Glass)(四)
玻璃(Glass)(四)
臺北市立第一女子高級中學化學科何鎮揚老師/國立台灣師範大學化學系葉名倉教授責任編輯
彩色玻璃
彩色玻璃往往是通過添加著色劑實現的,玻璃中的著色劑能對投射到玻璃上的白光進行選擇性的吸收,從而改變了透過玻璃光線的光譜組成,使玻璃顯示出各種顏色。在光學、光化學上,還可利用具有截止波長(cut-off wavelength)的有色或近似無色玻璃來濾除某些不需要波段的光,如紫外光濾光片等。顯色的強弱與著色劑的種類及數量有關,也與工藝制度有關,根據著色劑在玻璃中的狀態,可把著色劑分為離子著色劑和膠體著色劑兩類。部分著色劑與對應玻璃的顏色關系如下表所示。離子著色劑主要包括一些有色金屬氧化物和鹽。
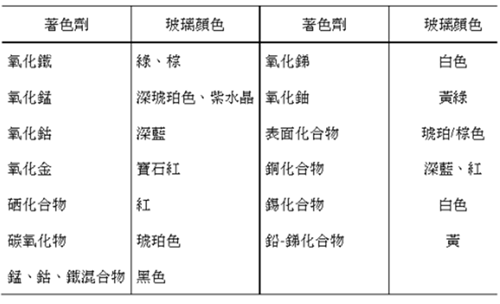
鐵化合物:常用原料有紅粉(Fe2O3)以及硫酸工業的副產品Fe2(SO4)3,還有赤鐵礦、褐鐵礦、菱鐵礦等天然礦物。鐵在玻璃中可以不同價態存在,當Fe2+、Fe3+同時存在時,因Fe2+/Fe3+比例不同而使玻璃呈藍綠到黃綠的不同顏色。
化合物:著色能力強,性能穩定,其著色不受熔制條件的影響,氧化鈷的引入量為玻璃量的0.001 %~0.01 %。當玻璃中含有萬分之二的鈷化合物時,玻璃呈深藍色。常用的鈷化合物有綠色的氧化亞鈷,黑色的氧化鈷和灰色的四氧化三鈷,以及碳酸鈷、硝酸鈷等。用氧化鈷著色時,在配合料中同時引入適量的氧化硼、氧化鉀、氧化鉛時,玻璃呈色更純正。
鎳化合物:常用的化合物有灰綠色氧化亞鎳(NiO)、黑色三氧化二鎳(Ni2O3)、綠色的氫氧化鎳[Ni(OH)2“>。NiO的引入量為玻璃量的0.003 % ~ 0.03 %。鎳化合物使玻璃呈棕色至紫色,因玻璃組成變化而不同。
銅化合物:常用原料有紅色結晶粉末氧化亞銅(Cu2O)、黑色粉末氧化銅(CuO)和藍綠色晶體的硫酸銅(CuSO4)。銅在玻璃中因含量和價態不同而使玻璃呈現從藍到綠的不同顏色。CuO的引入量為玻璃量的1 % ~ 2 %。
錳化合物:常用的原料有氧化錳(Mn2O3)、軟錳礦(MnO2)和高錳酸鉀(KMnO4)。Mn4+使玻璃著成紫色,用量過多時呈黑色,以Mn2+存在時,玻璃呈淡灰色,用二氧化錳和氧化鐵可使玻璃著成深紅褐色。
鉻化合物:常用的化合物有鉀或鈉的重鉻酸鹽或鉻酸鹽,而很少用氧化鉻。Cr3+著色能力極強,含量為玻璃的千分之一時,玻璃呈嫩綠色。
鈾化合物:常用的化合物有氧化亞鈾(UO2)、三氧化鈾(UO3)和鈾酸鈉(Na2U2O5‧3H2O),均為棕黃色粉末。UO3引入量為配合料的0.5 % ~ 2 %,U6+使玻璃呈熒光黃綠色。
主要的膠體著色劑有金、銀、銅、鎘、硒、碲等的化合物。膠體著色對熔制條件要求較嚴,玻璃一般都須經過熱處理才能呈色。膠體著色劑具有以下幾種:
金的化合物:常用的原料為三氯化金(AuCl3)和硝酸金[Au(NO3)3“>。金的引入量一般為玻璃量的0.00l % ~ 0.1 %。膠體金使玻璃著成強紫紅色,為使呈色穩定,應在配合料中引入0.5 % ~ 2.5 %的二氧化錫。
銀的化合物:常用的原料有AgNO3、Ag2CO3、AgCl、Ag2O。銀的加入量為玻璃量的0.05 % ~ 0.25 %,膠體銀使玻璃呈金黃色。
銅的化合物:常用的原料有氧化亞銅和硫酸銅,氧化亞銅的引入量為玻璃量的0.05 % ~ 0.25 %,膠體銅使玻璃著成紅色。
硒的化合物:常用的原料有金屬硒粉(高溫型紅色粉末或低溫型黑色粉末)和白色的硒酸鈉(Na2SeO3)粉。硒便玻璃著成玫瑰色至黃紅色。熔製時,溫度不能太高,氧化氣氛不能太強,否則會造成硒的揮發與氧化。硒酸鈉易溶於水,易潮解,有毒性,觸及皮膚能引起灼傷,注意乾燥保存,安全使用。
鎘的化合物:常用的原料有硫化鎘(CdS)和氧化鎘(CdO),硫化鎘使玻璃呈黃色(金絲雀色)。在熔製時,會發生下列反應:
2 CdS + 3 O2 → 2 CdO + 2 SO2
此外,還有很多功能性玻璃,如防輻射玻璃吸收有害射線、光色玻璃遇強光變色、鐳射玻璃、聲光玻璃、磁光玻璃等。玻璃的許多功能是通過去除或添加元素來實現的。看起來耀眼的水晶玻璃(1ead glass)是在玻璃中添加了鉛,使折射率增加;普通玻璃中加入硼化合物,得到派瑞克斯(Pyrex)玻璃,改變玻璃的導熱性;加入鋇元素,亦可提高折射率;加入釷的氧化物可大幅增加折射率,用以製造光學鏡頭;加入鐵元素的玻璃對吸收紅外光非常有效;加入鈰元素能增強玻璃對紫外線吸收,電影放映機中就使用該種玻璃來隔熱。總之,玻璃的種類非常之多,應用範圍也非常廣泛。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 
