化學平衡(一):平衡常數Kc與Kp
化學平衡(Chemical Equilibrium)(一):平衡常數Kc與Kp
臺北縣立三民高級中學化學科林秀蓁老師/國立臺灣大學化學系陳藹然博士責任編輯
在一個物質與熱量均不可出入的孤立系統(isolated system),某一可逆反應其所有狀態(濃度、壓力)皆不再改變時,代表此反應已達平衡狀態(equilibrium state)。化學平衡為一動態平衡(dynamic equilibrium),若以更細微的實驗觀察(同位素標記、沈澱物的晶體形狀…)就可察覺此時反應仍不斷在進行,其反應之正逆反應速率相等且不為零。
平衡常數(equilibrium constant)為1893年波斯坦(M. Bodenstein, 1871 ~ 1942)經由實驗結果歸納所發現的概念,下表為波斯坦在448℃下 \(H_2+I_2\rightleftharpoons 2HI\) 反應之平衡後各物質的濃度實驗數據及其計算過程:
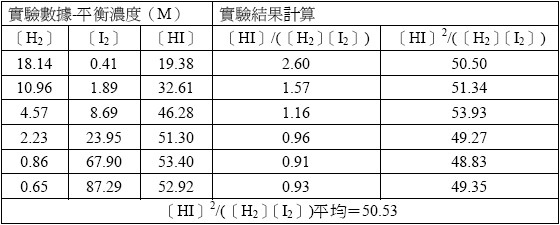
其發現在448℃下 \(H_2+I_2\rightleftharpoons 2HI\) 的平衡濃度以 \(\displaystyle\frac{[HI]^2}{[H_2][I_2]}\) 運算下約為常數,此常數不因反應溫度改變。
根據上述實驗結果,我們是不是可以假設:
如果有一個反應 \(aA+bB\rightleftharpoons cC+dD\) ,其平衡常數式可推測為 \(\displaystyle K_c=\frac{[C]^c[D]^d}{[A]^a[B]^b}\) 。
我們先從反應為單一步驟反應來討論其平衡常數式。因為反應處於平衡狀態,所以正反應速率等於逆反應速率。
\(R_{\text{正}}=k_1[A]^a[B]^b=R_{\text{逆}}=k_{-1}[C]^c[D]^d \)
故 \(\displaystyle \frac{k_1}{k_{-1}}=\frac{[C]^c[D]^d}{[A]^a[B]^b}=K_c\) 與假設相符。
如果此反應非單一步驟反應,例如 \(NO_2Cl\) 的分解反應:\(2NO_2Cl\rightleftharpoons 2NO_2+Cl_2\)
其反應機構(reaction mechanism)與正逆反應速率各為:
\(NO_2Cl\rightleftharpoons NO_2+Cl\)
\(R_{\text{正}}=k_1[NO_2Cl]\),\(R_{\text{逆}}=k_{-1}[NO_2][Cl]\)
\(NO_2Cl+Cl\rightleftharpoons NO_2+Cl_2\)
\(R_{\text{正}}=k_2[NO_2Cl][Cl]\),\(R_{\text{逆}}=k_{-2}[NO_2][Cl_2]\)
因為化學平衡中所有的步驟都需符合動態平衡的機制,亦即每一個步驟的正逆反應速率都應該相等,故上述反應達平衡時:
\(k_1[NO_2Cl]=k_{-1}[NO_2][Cl]\),且 \(k_2[NO_2Cl][Cl]=k_{-2}[NO_2][Cl_2]\)
可得 \(\displaystyle \frac{k_1k_2}{k_{-1}k_{-2}}=\frac{[NO_2]^2[Cl][Cl_2]}{[NO_2Cl]^2[Cl]}=\frac{[NO_2]^2[Cl_2]}{[NO_2Cl]^2}=K_c\)
即平衡常數 \(\displaystyle K_c=\frac{[C]^c[D]^d}{[A]^a[B]^b}\) ,與假設相符。
因此不論反應之反應機構為何,\(aA+bB\rightleftharpoons cC+dD\),\(\displaystyle K_c=\frac{[NO_2]^2[Cl_2]}{[NO_2Cl]^2}\)。
若在反應之反應物與生成物均為氣態,就可用分壓代替濃度而求得平衡常數 \(K_p\),\(K_c\) 與 \(K_p\) 的關係可以用理想氣體公式,即 \(P=(\frac{n}{V})RT\)
代入求得:
\[ K_p=\frac{P^c_CP^d_D}{P^a_AP^b_B}=\frac{([C]RT)^c([D]RT)^d}{([A]RT)^a([B]RT)^b}=\frac{[C]^c[D]^d}{[A]^a[B]^b}(RT)^{(c+d)-(a+b)}=K_c(RT)^{(c+d)-(a+b)} \]
即 \(K_p=K_c(RT)^{\text{生成物與反應物氣體莫耳數差}}\)
而在非均態平衡中,純固體與純液體在溫度與壓力不變的情況下,濃度為定值,其濃度值就包含在平衡常數中,因此這些物質的濃度壓力項目將不會出現在平衡常數式中;例如 \(CaCO_{3(s)}\rightleftharpoons CaO_{(s)}+CO_{2(g)}\) 其反應 \(CaCO_{3(s)}\) 與 \(CaO_{(s)}\) 均為固體,純固體在溫度與壓力不變下濃度為定值,故平衡常數式 \(K_c=[CO_2]\),且其平衡常數 \(K_c\) 值已包含 \(CaCO_{3(s)}\) 與 \(CaO_{(s)}\) 的濃度。
參考資料
1. Charles E.Mortimer 著,吳惠平 譯述,《大學化學》,科技圖書股份有限公司,民國84年。
2.曾國輝編著,《化學平衡》,建宏出版社,民國84年。
3. 鍾崇燊教授,〈速率常數與平衡常數〉,高中化學學科中心電子報第11期,2006年11月15日。
http://chem.kshs.kh.edu.tw/epaper/c_epaper_no11/chem01.pdf


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係
化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 

讲述很清晰,有条理,网页很漂亮!
歡迎使用,多謝稱讚。
有一個疑問想請教
在證明平衡常數的表示法 不需考慮反應機構的部分
為何可直接將方程式相加 平衡常數就可相乘(該如何解釋)
前後邏輯的推算不太理解
謝謝
我跟上面那位有同樣的疑問
我也是跟上面有同樣疑問