分子速率的馬克士威分布
分子速率的馬克士威分布 (Maxwell’s Distribution of Molecular Speed)
國立臺灣大學物理學系98級 蔡亦涵
從小到大,班際運動會一定有一個項目─大隊接力,第一棒率先在跑道上奔馳,接著交給第二棒,繼續在跑道上揮灑青春的汗水,等到最後一棒跑回終點的那一剎那,裁判按下手中的碼錶,時間靜止那一刻,碼錶上面的數字記錄著我們一起完成的故事。這時候如果我們把總共跑的距離除以這個時間,會得到一個「速率」的概念,那這個速率代表什麼呢?其實這個速率是「平均速率」,也代表著平均每位選手的速率。
這時候問題就來了,既然這個叫做平均速率,難道大家都用這個速率在跑嗎?很明顯的,並不是每位選手都跑一樣的速率,其實大家有快有慢,這個「平均」代表的是我們這一個「群體」,「個別」是有差異的。
現在考慮一個方盒子,我們可以測得方盒子內的溫度,根據氣體動力論(kinetic theory of gas),我們知道溫度跟分子速率有關,但我們測得的這個速率只能「代表群體」,如同上述大隊接力的例子,分子運動有快有慢,但分子的數目就這麼龐大,不可能知道每個分子運動的速率,更別說運動方向了,這個結果實在令人沮喪。
但上帝關上一扇門,一定會為我們開另一扇窗,這時候聰明的物理學家─馬克士威(Maxwell)和波茲曼(Boltzmann),提出了統計力學(statistical mechanics)一個很重要的理論─馬克士威-波茲曼分布(Maxwell-Boltzmann distribution):
\(\displaystyle\frac{N_i}{N}=\displaystyle\frac{e^{\displaystyle(-\frac{E_i}{kT})}}{\sum_j e^{\displaystyle(-\frac{E_j}{kT})}}\)
其中 \(N\) 代表總分子數,\(N_i\) 代表能量為 \(E_i\) 的分子數。
這個理論很重要的假設是:不考慮相對論效應、沒有量子現象、分子數量相當龐大且忽略除了碰撞之外的交互作用。這個公式描述了在某固定溫度 \(T\) 的情形下,各能量分子所佔有的比例,\(k\) 為波茲曼常數。現在我們把公式做個改寫,分子、分母同乘某個常數 \(C\),使分母的數值變成 \(1\),那麼公式變成:
\(\displaystyle\frac{N_i}{N}=Ce^{(\displaystyle-\frac{E_i}{kT})}\equiv P(E_i)\)
\(P(E_i)\) 代表能量為 \(E_i\) 的機率。更精確來說應該是機率密度(probability density),大家如果第一次聽到這個名詞,可能會覺得很疑惑,以下就用一些圖來說明。
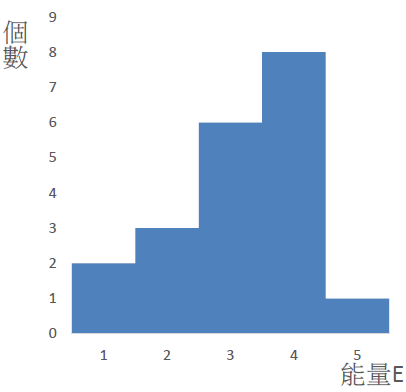
上圖總共有 \(20\) 個粒子,各能量具有的粒子數也都標示出來,現在以 \(E=2\) 為例,機率明顯看出是:
\(\displaystyle\frac{N_2}{N}=\frac{3}{20}\)
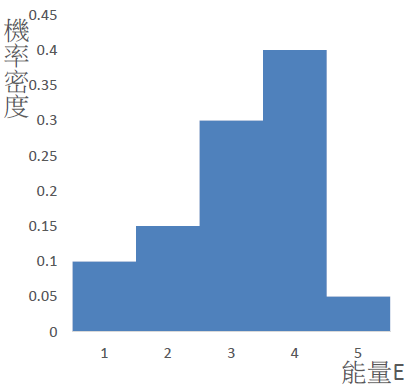
而這個算出來的數值恰巧等於 \(E=2\) 那條長條「面積」所佔整個藍色部分面積的比值,於是我們把圖轉換成這樣:
這樣就一目了然了,機率本身有「面積」的感覺,它是由「機率密度」乘以「底」得到的,因為現在能量是不連續的,每一個能量差都是 \(1\),所以機率密度恰巧等於機率。
此時我們把能量當成連續分布,那麼在能量 \(E_i\) 附近的機率變成:
\(Ce^{(-\displaystyle\frac{E_i}{kT})}\mathrm{d}E\)
現在我們想要知道速率的分布,於是我們把 \(E_i\) 用 \(\frac{1}{2}m(v_x^2+v_y^2+v_z^2)\) 代入,因為有三個方向,所以機率寫成:
\(Ce^{(-\displaystyle\frac{\frac{1}{2}m(v_x^2+v_y^2+v_z^2)}{kT})}\mathrm{d}v_x\mathrm{d}v_y\mathrm{d}v_z\)
分別對三個方向積分,積分範圍皆為 \(-\infty\) 到\(\infty\),且機率的總和必須為 \(1\),於是:
\(\int_{-\infty}^{\infty}\int_{-\infty}^{\infty}\int_{-\infty}^{\infty}Ce^{(-\displaystyle\frac{\frac{1}{2}m(v_x^2+v_y^2+v_z^2)}{kT})}\mathrm{d}v_x\mathrm{d}v_y\mathrm{d}v_z=1\)
經過整理我們得到機率密度:
\(P(v_x,v_y,v_z)=\sqrt{\displaystyle\frac{m}{2\pi kT}}^3e^{(-\displaystyle\frac{m(v_x^2+v_y^2+v_z^2)}{2kT})}\)
這個方程式告訴我們各個分量的機率密度,但是我們比較感興趣的是速率,即為速度大小,不管他的方向,於是我們有以下式子:
\(\int_{-\infty}^{\infty}\int_{-\infty}^{\infty}\int_{-\infty}^{\infty}\sqrt{\frac{m}{2\pi kT}}^3e^{(-\frac{m(v_x^2+v_y^2+v_z^2)}{2kT})} \mathrm{d}v_x\mathrm{d}v_y\mathrm{d}v_z=\int_{0}^{\infty}\sqrt{\frac{m}{2\pi kT}}^3e^{(-\frac{mv^2}{2kT})}4\pi v^2 \mathrm{d}v\)
這是將直角坐標系的積分轉換成球座標系的積分,經過整理:
\(\int_{0}^{\infty}\displaystyle\sqrt{\frac{m}{2\pi kT}}^3e^{\displaystyle(-\frac{mv^2}{2kT})}4\pi v^2 \mathrm{d}v=\int_0^{\infty}P(v)\mathrm{d}v\)
我們可以得到跟分子速率有關的機率分布:
\(P(v)=\displaystyle\sqrt{\frac{2}{\pi}(\frac{m}{kT})^3}v^2e^{(\frac{-m}{2kT})v^2}\)
這就是分子速率的馬克士威分布(Maxwell’s Distribution of Molecular Speed)。
這個機率密度公式告訴我們,在某個溫度 \(T\) 的情形下,分子速率為 \(v\) 所佔有的機率密度。我們可以利用這個公式進一步算出哪個速率的機率最高、平均速率、方均根速率等等,如下所示,其中方均根速率不偏不倚等於氣體動力論裡面推導過的方均根速率。
機率最大的速率 \(V_p=\displaystyle\sqrt{\frac{2kT}{m}}\)
平均速率\(V_m=\displaystyle\sqrt{\frac{8kT}{m}}\)
方均根速率 \(V_{rms}=\displaystyle\sqrt{\frac{3kT}{m}}\)
有趣的是,就算我們有能力在一開始時故意安排氣體分子,讓它們不滿足馬克士威(也等同於馬克士威-波茲曼)分布,但氣體分子還是會透過大量的碰撞去交換能量與動量,於是在經過一小段時間後,系統就滿足馬克士威分布了!這可以從圖3的電腦模擬中看出來(圖3是個很大的檔案,約25MB,故建議讀者下載回去自行觀看動畫)。

圖3 (陳義裕繪) 故意安排氣體分子在一個方形的箱子內(上圖),讓它們不滿足馬克士威分布,但分子還是會透過大量的碰撞去交換能量與動量,於是在經過一小段時間後,系統就滿足馬克士威分布(淺藍色的曲線為理論預測)。
參考文獻
維基百科. Maxwell-Boltzmann distribution. http://en.wikipedia.org/wiki/Maxwell\(E2\)80\(93Boltzmann_distribution


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 玻色-愛因斯坦分布
玻色-愛因斯坦分布 ![[講座] 2016春季展望─天文宇宙大發現](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/03/lec.png) [講座] 2016春季展望─天文宇宙大發現
[講座] 2016春季展望─天文宇宙大發現  過阻尼, 欠阻尼, 臨界阻尼
過阻尼, 欠阻尼, 臨界阻尼  【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象
【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象 ![[演講] 2014諾貝爾獎物理獎得主中村修二:嶄新光明大道](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/08/620_280.jpg) [演講] 2014諾貝爾獎物理獎得主中村修二:嶄新光明大道
[演講] 2014諾貝爾獎物理獎得主中村修二:嶄新光明大道 ![[影音] CASE【百秒說科學】 微中子系列](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/01/pp1268545.png) [影音] CASE【百秒說科學】 微中子系列
[影音] CASE【百秒說科學】 微中子系列  柯爾磁光效應
柯爾磁光效應 ![[講座] 星際效應,有影無?-CASE電影科普講座](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2014/12/星際效應宣傳圖-620x280.gif) [講座] 星際效應,有影無?-CASE電影科普講座
[講座] 星際效應,有影無?-CASE電影科普講座 

密閉空間中,達熱平衡裡想氣體平均速率應小於方均根速率
平均速率算錯了