弗洛斯特圖
弗洛斯特圖 (Frost diagram)
國立臺灣師範大學化學系三年級 俞姿宇
- 簡介
弗洛斯特圖 (Frost diagram) 或稱自由能 ─ 氧化數圖 (free energy-oxidation state diagram) 是單一種元素的氧化態與自由能的關係圖,單一種元素以不同氧化態存在的分子,在互相比較之下,氧化還原對 (redox couple) 的還原電位,電位差越大代表反應趨勢越強,此種圖示法是很好的判讀工具。
縱軸為電位 \(NE^\Theta\),橫軸為氧化數 \((N)\),氧化數值以遞增或遞減排列都是可以被接受的,值得注意的是橫軸的座標必須合乎線性比例,即使該元素無法存在於所有可能得氧化態。
- 與氫離子濃度關係
氧化還原反應式中通常有氫離子參與,根據能斯特方程式 (Nernst equation),pH 值會影響還原電位,因此必須注意圖中的 pH 值,我們也可以建構出不同 pH 值的 Frost diagram 來比較酸性溶液、鹼性溶液中的電位關係。
\(\displaystyle E=E^\circ-\frac{0.059}{n}\log Q\)
\(E\):還原電位 \(E^\circ\):標準還原電位 \(n\):轉移電子數目 \(Q\):反應商數
- 舉例
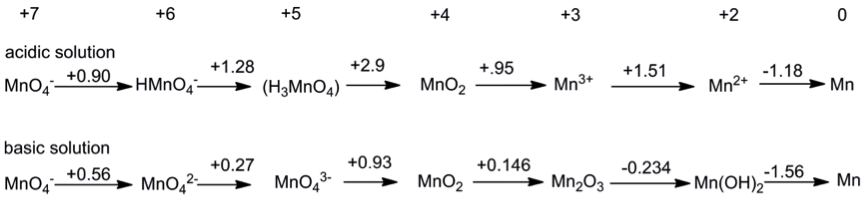
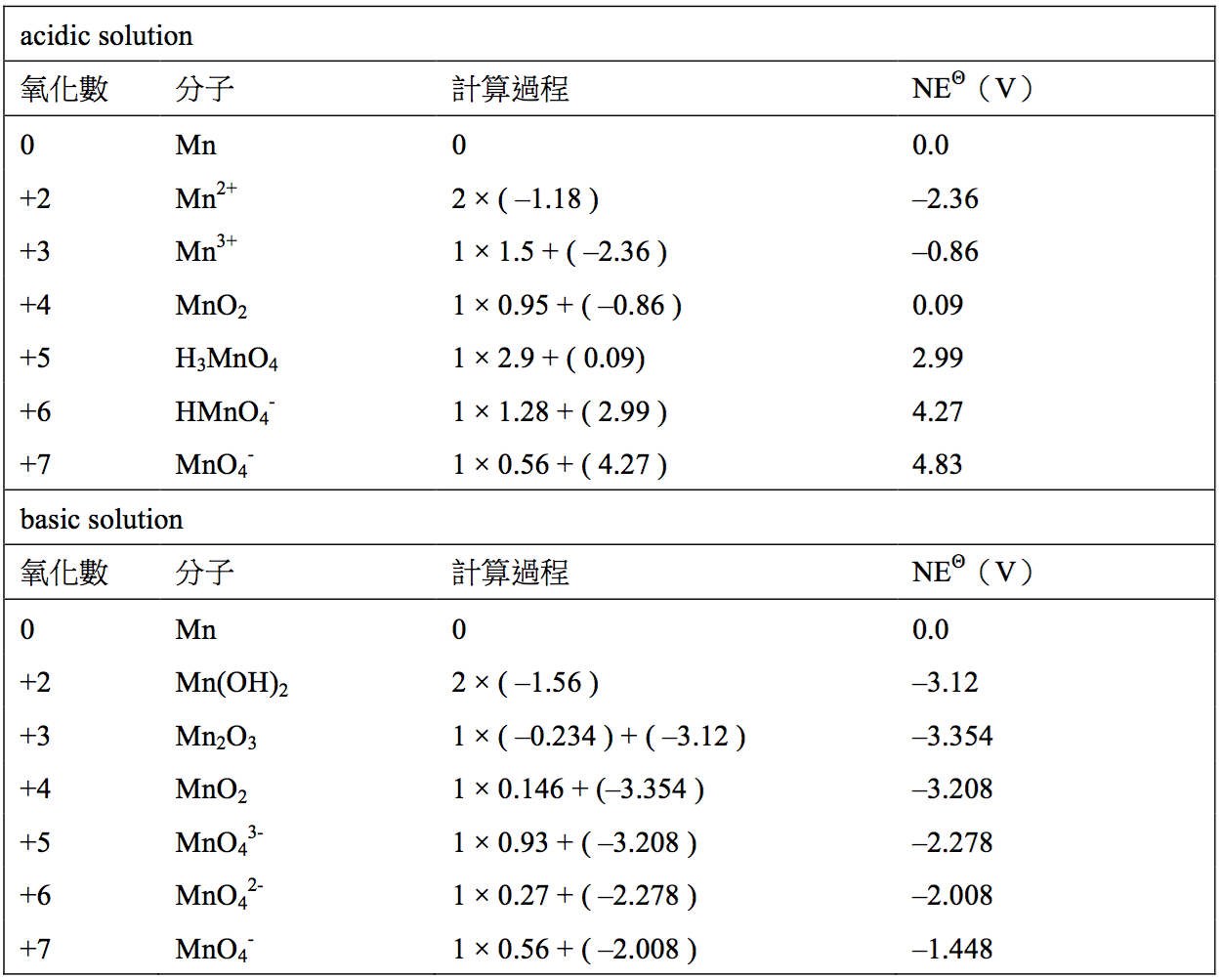
以錳(Manganese)舉例說明如何建構Frost diagram,首先從錳的拉蒂麥爾圖(Latimer diagram)(圖一),計算出所有氧化還原對(Redox couple)的 \(NE^\Theta\),如表一所示,從錳二價離子還原成錳零價,此過程涉及兩個電子轉移,\(NE^\Theta\) 為 \(2\times (-1.18V)=-2.36\),錳三價離子還原成錳二價離子,此還原反應是再加入一個電子,因此在前一個步驟的 \(-2.36V\) 再加上 \(+1.51\),得到相對於錳零價的能量高低。1
註:在此的acidic solution和basic solution分別指的是 \(1M\) 標準酸性溶液、\(1M\) 標準鹼性溶液
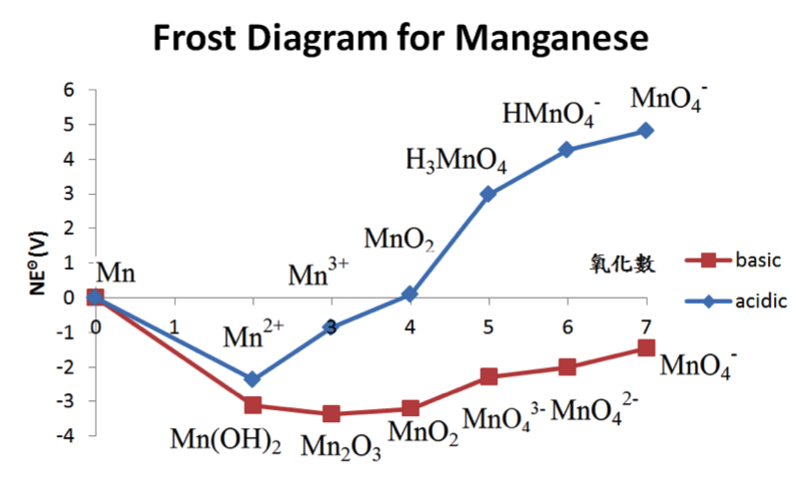
根據表一的計算結果作圖如下:
- 判讀熱力學穩定性
任意兩氧化態間的連線斜率等於該氧化還原對(Redox couple)的還原電位,比較任何兩條直線的斜率,直線越陡峭,電位差越大。
由於 \(NE^\Theta\) 正比於吉布士自由能(Gibbs energy)\(G=-nFE^\Theta\) ,\(F\) 是法拉第常數,因此Frost diagram相當於自由能與氧化數的作圖,吉布士自由能的意義是在定溫定壓下,化學反應會趨向低吉布士自由能的方向,處於越低點的物種越容易穩定存在,如:酸中的錳二價離子。
需注意的一點是除了熱力學之外此圖不提供任何動力學的資訊,也就是說反應速率的快慢無法從圖中判讀,相間的物種變換,牽扯多個鍵結斷裂與生成,能障太大,不容易發生。
- 判斷氧化劑、還原劑
氧化數低者為氧化劑,氧化數高者為還原劑,另一種判斷方法是看兩點連線斜率大於零,位置較高者是氧化劑,反之,斜率小於零,位置較高者是還原劑,而且斜率越陡的是越強的氧化劑或還原劑。
對錳而言,無論在酸性或鹼性條件下,縱軸位置最高的 \(\mathrm{MnO_4^-}\),標準還原電位值最大,在化學反應中容易獲得電子,還原成其他氧化數較低的化合物,是強氧化劑。而錳金屬與氧化數2的分子間連線斜率小於零,容易失去電子,因此是還原劑,在酸中氧化成錳二價離子,在鹼中則以氫氧化錳存在。
- 歧化反應 (disproportionation)、歸中反應 (comproportionation)
在弗洛斯特圖中,若存在任何一點高於其左右兩側物種的連線,則處於高點的物種會歧化(disproportionate)成兩側物種;若低於兩側物種的連線,則這兩個反應物會歸中(comproportionate)成中間的物種,得到單一產物2,如:酸中同時存在錳零價和錳三價離子時,很容易氧化還原成錳二價離子。
參考文獻
- Chemistry 2810. Introduction to the Chemistry of the Elements – http://classes.uleth.ca/200501/chem2810a/lecture_20.pdf
- Atkins, P. W. Overton, T., Rourke, Jonathan P., Weller, M. and Armstrong, F. A. (2010) Shriver & Atkins’ inorganic chemistry. Oxford : Oxford University Press. ISBN 9780199236176P.164-168


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  化學的填字遊戲?
化學的填字遊戲?  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 
