晶格能
晶格能 (Lattice enthalpy)
國立臺灣師範大學化學系 趙崇瀚
陰離子與陽離子之間存在庫倫作用力彼此吸引,由於此種異性電荷之間的作用力非常強,比一般的凡德瓦力大得很多,故離子化合物大多是以離子晶體的形式存在。因此當陰陽離子結合形成特定晶體時,其焓值改變量決定了晶體的穩定性
,故可以定義晶格能(\(\Delta H_L\))為:一特定離子晶體分解成其組成的氣態陰陽離子的焓值改變量(式一)。在此定義下,晶格能之值恆為正值,即代表破壞晶格所需的能量大小。
\(MX_{(S)}\rightarrow M^+_{(g)}+X^-_{(g)}~~~~~~~~~\)式一
然而,晶格能的大小不易直接量測,因此若要得知晶格能的大小,可以利用熱力學循環的方法,藉由其他已知的焓值間接推算得到。
以 \(\mathrm{MgBr_2}\) 為例:
\(\begin{array}{ll}Mg_{(S)}+Br_{2(L)}\rightarrow MgBr_{2(S)}&\Delta H_1\\Mg_{(S)}\rightarrow Mg_{(g)}&\Delta H_2\\Br_{2(L)}\rightarrow Br_{2(g)}&\Delta H_3\\Br_{2(g)}\rightarrow 2Br_{(g)}&\Delta H_4\\Mg_{(g)}\rightarrow Mg^{2+}_{(g)}+2e^{-}&\Delta H_5\\2Br_{(g)}+2e^-\rightarrow 2Br^-_{(g)}&\Delta H_6\\Mg^{2+}_{(g)}+2Br^-_{(g)}\rightarrow MgBr_{2(S)}&\Delta H_7=-\Delta H_L\end{array}\)
由於焓值是狀態函數,而上述所有反應恰形成一循環,故所有反應焓值的總和應為 \(0\),又其他的反應焓值較容易測得,故可以此方法推算出晶格能的大小。
除了以熱力學循環的方式推算晶格能之外,亦可利用玻恩-梅爾方程式(Born–Mayer equation)來估計晶格能的值(式二)。
\(\displaystyle \Delta H_L=\frac{N_A\times \left|Z_AZ_B\right|\times e^2}{4\pi\epsilon_0d}\times(1-\frac{d^*}{d})A~~~~~~~~~\)式二
其中,\(N_A\) 代表亞佛加厥常數、\(Z_A\) 及 \(Z_B\) 代表陰陽離子的電荷乘積;\(e^2\) 表電子電荷的電量平方;\(d^*\) 是一常數(\(34.5~pm\));\(d\) 則是陰陽離子之間的距離;\(A\) 為常數,根據不同的離子結構會有不同的值。
| 晶體結構 | A |
| 氯化銫CsCl | 1.763 |
| 螢石CaF2, Fluroite | 2.519 |
| 氯化鈉NaCl, Rock salt | 1.748 |
| 金紅石TiO2, Rutile | 2.408 |
| 閃鋅礦ZnS, Sphalerite | 1.638 |
| 纖維鋅礦ZnS, Wurtzite | 1.641 |
表一\(~~~\)不同晶體結構之 \(A\) 值(來源:作者整理)
根據式二,我們能夠得到一結論:\(\Delta H_L\) 正比於 \(\frac{\left| Z_AZ_B\right|}{d}\)
此等式是考慮陰陽離子之間的庫倫吸引、排斥力所得的結論。
然而,不同離子晶體的組成離子間所含共價性不同,再加上在固態晶體內離子間的距離非常小,所以凡德瓦力的影響又變得更顯著,種種因素說明了玻恩-梅爾方程式這單純以離子性的角度去估計晶格能所得之值,與以熱力學循環搭配實驗數值所得之值會有所偏差。
有了晶格能的概念之後,我們能夠進一步對晶體的性質做更深入的討論。以鹼土族的碳酸鹽熱分解為例,金屬碳酸鹽受熱分解成金屬氧化物及二氧化碳(式三)。
\(\mathrm{MCO_{4(s)}}\underset{\Delta}{\rightarrow}MO_{(s)}+CO_{2(g)}~~~~~~~~~\Delta H~~~\)式三
而若是金屬陽離子的半徑越小,其碳酸鹽的熱分解溫度越低,即代表分解反應較容易進行。要探究此現象的原因,亦可從晶格能的角度切入。
式三的 ∆H = ∆H分解 + ∆HL(MCO3) – ∆HL(MO),而 ∆H分解 是一極大的正值,所以若是反應要容易進行,∆HL(MCO3) – ∆HL(MO)的值越負越好。又由式一的結論,我們已知 \(\Delta H_L\) 正比於 \(\frac{\left| Z_AZ_B\right|}{d}\) ,在陰陽離子電荷乘積相等的情況下,\(\Delta H_L\) 受陰陽離子之間距離影響。
所以 \(\Delta H_L(\mathrm{MCO_3})-\Delta H_L(\mathrm{MO})\) 之值正比於 \(\frac{1}{d_{MCO_3}}-\frac{1}{d_{MO}}\)(恆負),又在我們的討論情況內陰離子的半徑都不變,只有陽離子的大小會改變,而若是陽離子大小越小,\(\frac{1}{d_{MCO_3}}-\frac{1}{d_{MO}}\)的值會越負(\(\frac{1}{r_M+r_{CO_3^{2-}}}-\frac{1}{r_M+r_{O^{2-}}}\) , \(r_M\) 越小值越負),故碳酸鹽熱分解的焓值改變量雖然仍是正值但會比較小,因此反應較容易進行,故熱分解的溫度會比較低。
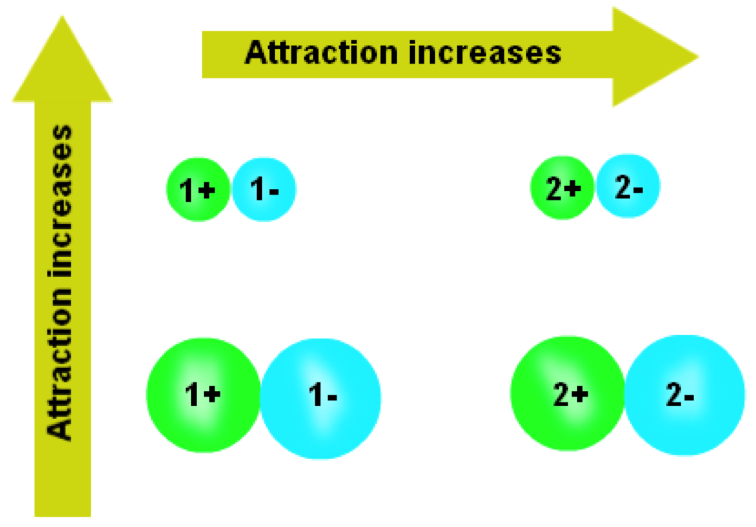
總結以上,我們可以知道:1、離子半徑越小、晶格能越大;2、電荷乘積越大、晶格能越大,如圖一。
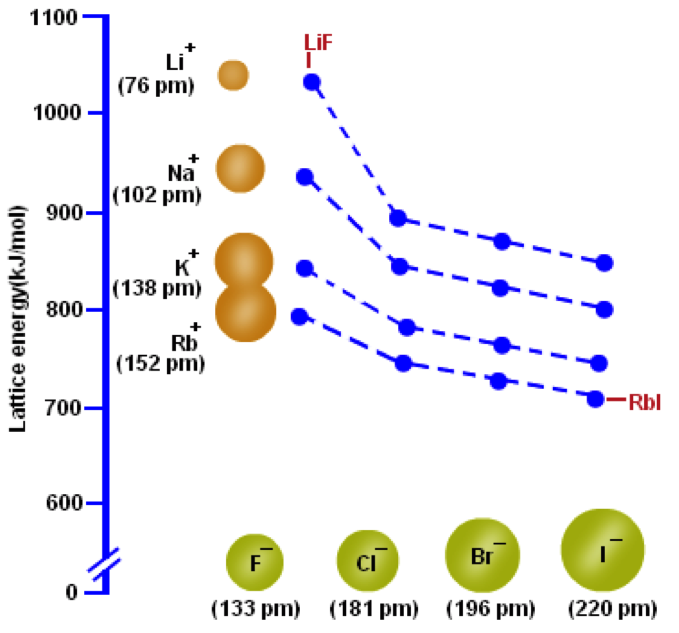
舉例來說,若以常見的鹼金屬與鹵素所形成的鹽類來比較(圖二),氟化鋰因為具有最小的離子半徑組合,晶格能最大;而碘化銣因為具有最大的離子半徑組合、其晶格能最小。
參考文獻
- Atkins; Overtone; Rourke; Weller; Armstrong (2009) Inorganic Chemistry. W. H. Freeman and Company
- 維基百科 http://en.wikipedia.org/wiki/Lattice_energy
- Chemwiki
http://chemwiki.ucdavis.edu/Inorganic_Chemistry/Crystal_Lattices/Thermodynamics_of_Lattices/Lattice_Energy%3A_The_Born-Haber_cycle - Lattice Energy, Lattice Energy Trend, Lattice Energy Equation
http://chemistry.tutorvista.com/inorganic-chemistry/lattice-energy.html


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 暖暖包的原理
暖暖包的原理  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第
化學傳記:法拉第不為人知的一面(三):皇家研究院與法拉第  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
