光延反應
光延反應 (Mitsunobu reaction)
國立臺灣師範大學化學研究所 胡婷嘉
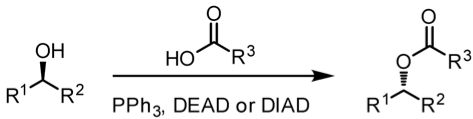
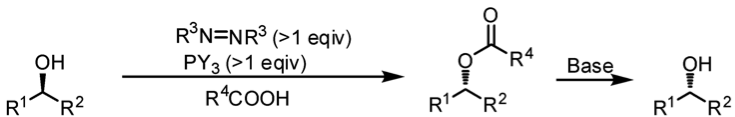
光延反應1,2是 1967 年由日本的化學家 Oyo Mitsunobu 等人提出的。以醇類的酯化為例,先利用三苯基膦 (triphenylphosphane, PPh3) 以及偶氮二羧酸二乙酯 (Diethyl diazenedicarboxylate, DEAD) 或偶氮二甲酸二異丙酯 (diisopropyl azodicarboxylate, DIAD) 活化親核試劑 — 羧酸,再將一級或二級醇有效的醯化;若用不同的親核試劑攻打的話,可以將醇轉換成不同的官能基,如:酯基、胺基…等。由於反應條件溫和,轉換率很高、且可以置換成很多不同的官能基,在現代有機合成中是很常見的反應。
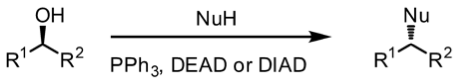
式一為光延反應的總反應式,將一級或二級醇用羧酸醯化,而式二則是用不同的親核試劑 (Nu–) 取代 OH 基團的反應式。而這個反應由於產物的立體組態反轉,是一種雙分子親核反應 (SN2);且因為立體障礙的關係,只有一級和二級醇可以被親核試劑攻擊,三級醇無法進行反應。
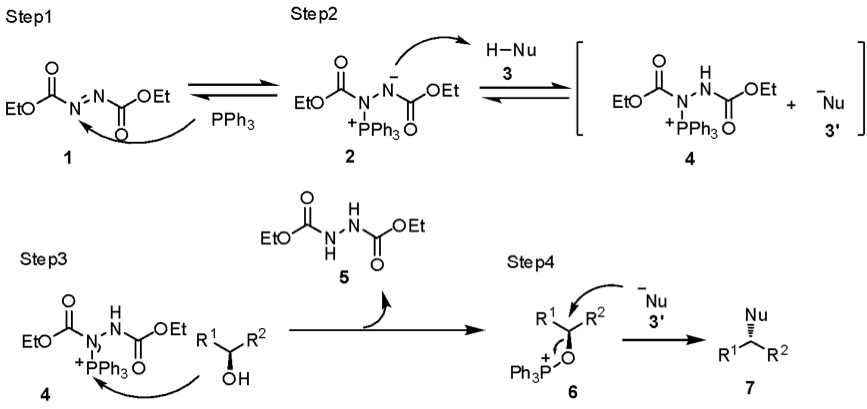
光延反應的反應機構很複雜,有很多不確定的中間體,目前普遍推測的反應機構如圖一。
第一步,三苯基膦和 DEAD 結合,生成 2 號的內鹽中間體 (betaine intermediate),第二步則是親核試劑 3 的去質子化,形成 4 號中間體和活化的親核試劑 3’,從這一步可以看到,若親核試劑越容易被去質子化,即可以生成更多的 -Nu (3’),有利此反應的進行;因此反應的限制條件為親核試劑的 pKa 值必須小於 15 才可產生反應,且親核試劑的酸性越強(pKa越小),反應性越好。
第三步是中間體 4 被醇基上的氧攻擊,而 DEAD 再去質子化醇基上的氫,產生聯胺的副產物 5,並且生成重要的磷氧中間體 6。
最後的第四步,磷氧中間體 6 和剛剛被去質子化的親核試劑 3’ 進行雙分子親核取代反應 (SN2),生成立體組態翻轉的產物 7。
休斯教授在 1988 年指出,生成 4 號中間體的速度是很快的,但生成重要的磷氧中間體 6 的速度則較慢,且醇鹽可以促進中間體 6 的生成,從這裡可以也看出反應跟親核試劑的酸鹼性有很大的關係3。
在此反應中,試劑的添加順序也會影響反應的發生。一開始要先將三苯基膦、親核試劑,以及醇先溶於適當的溶液中(通常是四氫呋喃),溫度降至 0℃,然後滴加入 DIAD,最後回到室溫等到反應完成。
由於反應的過程中,需要加入大量的化學藥品,所費不貲,因此也有人嘗試改良光延反應,例如用雙(4-氯苄基)偶氮二甲酸酯(Bis(4-chlorobenzyl) azodicarboxylate, DCAD) 來取代 DEAD5。反應中所產生的聯胺副產物可以用過濾的方法除去,並且可以回復到 DCAD 來重複使用。若在反應中加入(二乙酰氧基碘)苯,可以減少 DEAD 從當量減少為催化量,因為(二乙酰氧基碘)苯可以氧化聯胺的副產物回到 DEAD6。
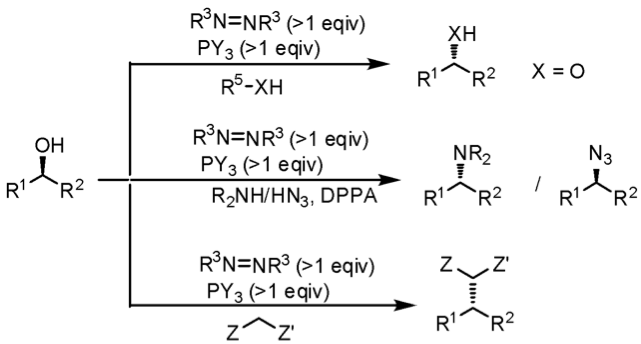
光延反應的應用廣泛,可以生成新的碳氧鍵、碳氮鍵甚至是碳碳鍵(圖二);也可以在溫和條件下做立體中心的轉換(圖三),以及用來合成芳香醚類化合物等等。
參考文獻
- Mitsunobu Reaction, Organic – Chemistry Portal
— http://www.organic-chemistry.org/namedreactions/mitsunobu-reaction.shtm - Jantzi, K (2001) Mitsunobu-Reaction. Name Reactions, 390
— http://www.chem.wisc.edu/areas/organic/studsemin/jantzi/jantzi-abs.pdf - Hughes, D. L., Reamer, R. A., Bergan, J. J., & Grabowski, E. J. J. (1988). A mechanistic study of the Mitsunobu esterification reaction. Journal of the American Chemical Society, 110(19), 6487-6491.
- Kurti, L., & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis, 294–295. Elsevier.
- Lipshutz, B. H., Chung, D. W., Rich, B., & Corral, R. (2006). Simplification of the Mitsunobu reaction. Di-p-chlorobenzyl azodicarboxylate: a new azodicarboxylate. Organic letters, 8(22), 5069-5072.
- Pelletier, J. C., & Kincaid, S. (2000). Mitsunobu reaction modifications allowing product isolation without chromatography: application to a small parallel library.Tetrahedron Letters, 41(6), 797-800.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 
