化學示範實驗:可口可樂神奇凝冰—過冷
化學示範實驗:可口可樂神奇凝冰—過冷 (Supercooling)
國立彰化師範大學化學系學生高連陽 / 國立彰化師範大學化學系楊水平副教授責任編輯
前言
市面上的“可口可樂神奇凝冰販賣機”搖一搖可樂瓶就會瞬間結冰,為什麼呢?可樂到底是如何變成可樂冰呢?現在就讓老師演示“可口可樂神奇凝冰”給大家觀賞吧!同學們,妳們也可以自製可樂冰喔!
示範實驗影片
請按此連結:可口可樂神奇凝冰—過冷現象(Supercooling),YouTube。
示範步驟
一、 示範前準備
1. 準備瓶裝可口可樂、冰塊、食鹽和塑膠盆等器材,如圖一所示。
圖一 準備示範所需的器材
2. 取冰塊與食鹽約以3:1的比例置入塑膠盆中約半滿,當作冷劑。
3. 放置一瓶瓶裝的可口可樂在半滿冷劑的塑膠盆中,再覆蓋約半滿的冷劑於此瓶上。用溫度計測量溫度,如圖二所示。
圖二 冰塊與食鹽混合可降到0℃以下
4. 靜置此瓶可口可樂約1小時,如圖三所示。
圖三 靜置可樂瓶
二、 示範“可口可樂神奇凝冰”
1. 在靜置此瓶可口可樂1小時後,整個塑膠盆帶到上課的教室。
2. 先小心地移走上層的冷劑,然後慢慢地取出此瓶可口可樂,不要搖晃瓶內的可樂。
3. 在示範前,慢慢地打開瓶蓋釋放出二氧化碳,先倒一小杯自己喝一口,再關緊瓶蓋。
4. 然後用力搖晃數次,可樂就會瞬間結冰,如圖四所示。
圖四 可口可樂神奇凝冰(注意液面附近的顏色)
5. 先倒出一些結冰的可樂冰到另一個杯子給一位學生喝,然後傳此可樂瓶給學生觀看。
溶液和器材
1. 瓶裝可口可樂 1瓶
2. 冰塊 約600 g
3. 食鹽 約200 g
4. 塑膠盆 2個
5. 溫度計 1支
6. 飲用杯子 2個
原理和概念
● 水凝結成冰其實是一種結晶的過程,如果原本已有冰晶或其他物質存在時,就會提供凝結核讓其他水分子有附著之處可以結晶。
● 若水質純淨無雜質而且容器光滑,冰晶無處可以附著就無法形成,所以即使溫度低於水的凝固點也無法結冰。此時只要搖晃此瓶“超冷凍水”,使水分子之間劇烈碰撞而形成冰晶,其他水分子就會立即附著其上開始結晶,於是整瓶“超冷凍水”就瞬間結冰,此現象稱為過冷(Supercooling)。
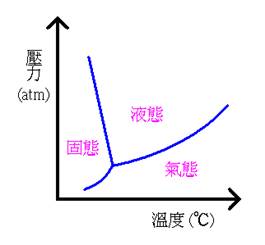
● 過冷現象即降低液體或氣體的溫度,但不使其凝固的過程。除了上述缺少凝結核而導致的過冷現象外,利用壓力改變凝固點也可以產生過冷現象,“可口可樂神奇凝冰”即是利用此原理製作。當靜置冷凍後的可口可樂,由於打開瓶蓋後釋放出二氧化碳,會降低壓力,因此凝固點會上升。
圖五 水的三相圖(此為示意圖,非實際圖)
● 在大自然中也有不少過冷現象發生,像是凍雨。凍雨就是過冷的液態雨滴落於地面或暴露在物體上時,迅速凝結為冰的天氣現象,通常發生於地面溫度0℃以下的天氣。凍雨的形成機制如下,一開始時是以雪的形式從高空雲層落下,在下降過程中遇到溫度高於冰點溫度的暖氣流層而完全融化為雨滴,而後在更低的高度又遇到溫度低於攝氏零度的冷氣流層,此時雨滴不再凝結,而是形成過冷的液態雨滴。過冷雨滴一旦遇到低於攝氏零度的物體的表面(提供凝結核)就會立刻凝結,形成細長條狀的冰棱,故稱之為凍雨。凍雨可以在物體表面形成一層透明的冰覆蓋層,這種冰覆蓋層被稱作「雨凇」,又稱「冰掛」。掛於各種植物上的雨凇或冰掛形成了冬季獨特的景色。
圖六 蘋果樹上的雨凇
圖片來源:維基百科,http://zh.wikipedia.org/zh-tw/凍雨
教學提示
1. 此示範實驗並非所有瓶裝飲料都能達到如同“可口可樂神奇凝冰”的效果,因此教師必須事先試做。
2. 示範時必須注意背景,若背景太雜亂或對比不夠強烈,則觀察者不易看到結冰的瞬間。
3. 若教學時間為一節課,建議教師先準備數瓶已過冷的可口可樂帶到教室,在開始上課時,用一瓶示範給學生觀看,其他瓶分組給學生親自操作,然後以互動討論方式讓學生瞭解凝冰現象的科學原理,剩餘的時間教師再為學生補充講解。
4. 若教學時間為兩節課,建議教師先準備一至二瓶已過冷的可口可樂帶到教室,在開始上課時,立即示範給學生觀看。接下來的時間讓學生親自動手做實驗,並於等待降溫的過程中,以互動討論方式讓學生瞭解變化現象背後的科學原理,並且教師補充相關內容知識。
5. 提醒示範者:現場演示示範實驗所展現的變化現象的臨場感,以及激發互動討論的教學效果,比單純的播放影片好很多。
問題和參考答案
1. 我們知道水的凝固點為0℃,若水冷卻至0℃,則一定會結冰嗎?
答:不一定。若水質純淨無雜質且容器光滑就可能會產生過冷現象,溫度降到0℃以下還是有可能不會結冰。
2. 為何冰塊加鹽可降溫至0℃以下?
答:當水要結冰的時候,水分子之間會產生氫鍵,而形成規律的晶體,所以如果水中溶解有其他的物質的話,會妨礙晶體的形成,於是使水的凝固點下降。冰塊表面有一層薄薄的水,如果灑上食鹽,食鹽便可以溶解在水中,此溶解會吸收其它水的熱量使溫度下降,於是混合後的鹽水凝固點會下降。
3. 為何要將瓶蓋打開再關上後用力搖晃?
答:由於可口可樂這類的碳酸飲料因瓶內灌入二氧化碳,壓力較大,因此冰點降低。在打開瓶蓋後後,瓶內二氧化碳逸失,壓力降低,使得冰點溫度上升。再者,二氧化碳逸失時會吸收部分熱量,所以飲料就產生快速結冰的現象。
安全
● 示範這個實驗必須戴可丟棄的手套,以免凍傷。
● 示範這個實驗實行適當的風險評估是老師的責任。
參考資料(擷取日期:2010年7月)
1. 可口可樂神奇凝冰,http://iamanson.spaces.live.com/ … 4189790!10413.entry。
2. 初中科學趣味實驗-水-凝固點-超冷凍Supercooling,http://www.youtube.com/watch?v=K6HuYIOakQc。
3. Supercooling, Wikipedia, http://en.wikipedia.org/wiki/Supercooling。
4. 凍雨,維基百科,http://zh.wikipedia.org/zh-tw/凍雨。
5. 消暑大絕招:輕鬆讓你的飲料瞬間結冰!流言追追追-【實驗精華片段】,YouTube,http://www.youtube.com/watch?v=cP86vPHTPDw。







 前一篇文章
前一篇文章 下一篇文章
下一篇文章 棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》 

請問假如把汽水直接放在冷凍庫(-8c)裡會成功嗎??
我看很多影片都這樣做~
那這樣不會氣爆嗎??
做這個實驗要用全新的汽水??開過的OK嗎??
純水的正常凝固點在273.15K(0℃),但它也可以在標準壓力下造成〝過冷〞現象,大約在231K(-42℃)下才造成晶體均勻成核作用(亦即在-42℃以上有可能不會凝結成為冰)。
我們的實驗是使用文章內提到的冷劑方法,放置可口可樂瓶在低於-10℃完成的,且需要1~2小時。如果冷凍的時間不夠長,那麼打開瓶蓋後結冰的量就不會很多。我想汽水直接放在冷凍庫-8℃下,可能造成〝過冷〞現象的機率還是有的,只是時間可能要長一點,打開瓶蓋後結冰的量才會多。
在密閉的容器中,溫度愈低,氣體對水的溶解度愈大,氣體在液面上的壓力愈小,因此不會產生氣爆。
我們曾經試過礦泉水、飲用水、可樂汽水、茶水和運動飲料等利用冷劑的方法(放置約兩小時)造成〝過冷〞的機率很大,但是放在冰箱冷凍庫內造成結冰的機會很大(〝過冷〞的機率很小)。我們不曾試過開過的汽水,你可以試試看。
為甚麼冰會由上而下?????