簡單化學鍵結概念
簡單化學鍵結概念 (Chemical Bond)
臺北縣私立淡江高級中學化學科賴亭吟老師/國立臺灣大學化學系陳藹然博士責任編輯
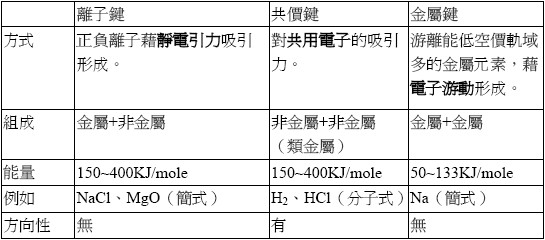
原子與原子、離子與離子間可以透過共用電子或電荷吸引力,以形成化學鍵(chemical bond)的方式結合在一起,生成化合物。化學鍵的種類可分為離子鍵、共價鍵及金屬鍵三種,分別介紹如下:
1. 離子鍵(Ionic Bonding)
帶相反電荷的陽離子與陰離子以庫侖吸引力產生鍵結,稱為離子鍵。
兩個電負度相差極大的原子(一般是金屬元素與非金屬元素),例如氯和鈉,電負度大的氯會從電負度小的鈉搶走一個電子,形成穩定Cl– 和 Na+,兩者再以庫侖靜電力結合在一起。離子鍵的強度和形成鍵結的離子電荷強度成正比與離子距離成反比, 離子半徑越小或所帶電荷越多,負、正離子間的作用就越強;例如鈉離子Na+半徑比鉀離子K+小,則氯化鈉NaCl中的離子鍵較氯化鉀KCl中的離子鍵強。
2. 共價鍵(Covalent Bonding)
如果是兩個電負度相近的原子間結合時,通常藉由共用價電子(valence electron)的方式,使彼此滿足八隅體(Octet rule)電子結構,這種鍵結為「共價鍵」, 一般是發生在非金屬元素與非金屬元素間。例如氧分子為兩個氧原子各自提供兩個價電子共用方式形成共價鍵。共價鍵又可分爲極性(Polar)共價鍵與非極性(Non-polar)共價鍵。
3. 金屬鍵(Metallic Bond)
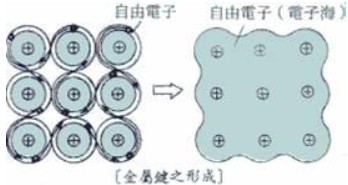
金屬原子間形成的鍵結比較特殊,稱為「金屬鍵」。金屬的最外層價電子容易游離形成自由電子,自由電子均可自由移動於整個金屬晶體中,並非專屬於某一個金屬陽離子,因此金屬陽離子如同沉浸在自由價電子形成的「電子海」中,成為穩定狀態,如下圖,故金屬鍵不具有方向性。
將以上三種化學鍵的整理比較如下表:
參考資料
1. WIKIPEDIA網站–Chemical Bond
http://en.wikipedia.org/wiki/Chemical_bond
2. 〈化學鍵理論〉,余曉清老師的認知與科學學習實驗室網站-大蕊’s化學鍵。
http://sciedu.cc.nctu.edu.tw/practice/peiyi/case/new_page_2.htm


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係
化學傳記:法拉第不為人知的一面(九):法拉第和社會的關係  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間 

不好意思 請問一下什麼是方向性 麻煩囉 謝謝
你的問題很好。我想原作的意思是在金屬中,各原子對周圍的作用是各向同性(isotropic),可參考http://en.wikipedia.org/wiki/Isotropy