沸點上升法求分子量的限制(上)
沸點上升法求分子量的限制(上)
國立臺灣師範大學化學系兼任教師邱智宏
一般而言非揮性溶質的分子量可依 $$\Delta T=K_bm_B$$,的公式來求出。然而現今的實驗室鮮少使用此法求取物質的分子量,唯在教學上,基於依數性質的應用及探討,此部分的內容仍有其存在的必要。但是此法在使用上有一些限制,尤其僅適用於稀薄的溶液中,此點在一般課程內容中甚少提及,以下將此公式的推導及假設詳述一遍,以免遭到誤用。
一、沸點上升公式的推導
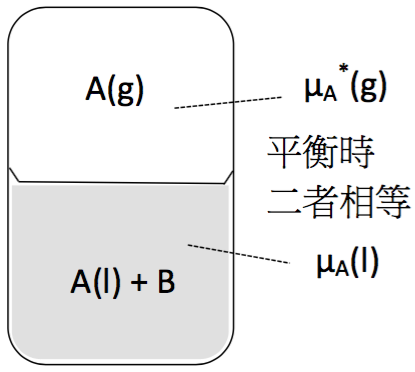
假設在理想溶液中,$$B$$ 為非揮發性(nonvolatile)溶質,$$A$$ 為溶劑如圖一所示,當系統達到平衡時,液相中 $$A$$ 的化學能($$\mu_A(l)$$)會等於氣相中 $$A$$ 的化學能($$\mu_A^*(g)$$),上標的 $$*$$ 代表其為純物質。
$$\mu^*_A(g)=\mu_A(l)~~~~~~~~~(1)$$
由熱力學的定律可知,相同狀況下,純溶劑的化學能永遠高於溶液的化學能,如下式所列,
其中 $$X_A$$ 代表溶劑的莫耳分率,其值小於 $$1$$,
故 $$\ln (X_A)<0$$。
$$\mu_A(l)=\mu^*_A(l)+RT\ln X_A~~~~~~~~~(2)$$
由(1)、(2)兩式可得
$$\mu^*_A(g)=\mu^*_A(l)+RT\ln X_A~~~~~~~~~(3)$$
將 $$X_A+X_B=1$$ 代入上式,並移項可得下式
$$\mu^*_A(g)-\mu^*_A(l)=RT\ln (1-X_B)~~~~~~~~~(4)$$
其中 $$\mu^*_A(g)-\mu^*_A(l)$$ 代表純溶劑從液相到氣相的化學能差,
即等於莫耳自由能的變化($$\Delta G_{vap}$$),因此
$$\displaystyle\ln(1-X_B)=\frac{\Delta G_{vap}}{RT}~~~~~~~~~(5)$$
另外,$$\Delta G_{vap}=\Delta H_{vap}-T\Delta S_{vap}$$,代入下式
$$\displaystyle\ln(1-X_B)=\frac{\Delta H_{vap}}{RT}-\frac{\Delta S_{vap}}{R}~~~~~~~~~(6)$$
當 $$X_B=0$$ 時,$$\ln (1-X_B)=\ln 1=0$$,即為純溶劑的情況,若其沸點為 $$T_b$$,代回上式
$$\displaystyle\frac{\Delta H_{vap}}{RT_b}=\frac{\Delta S_{vap}}{R}~~~~~~~~~(7)$$
將(7)代回(6)式
$$\displaystyle\ln(1-X_B)=\frac{\Delta H_{vap}}{RT}-\frac{\Delta H_{vap}}{RT_b}$$
$$\displaystyle\ln(1-X_B)=\frac{\Delta H_{vap}}{R}(\frac{1}{T}-\frac{1}{T_b})$$
$$\displaystyle\ln(1-X_B)=\frac{\Delta H_{vap}}{R}(\frac{T_b-T}{TT_b})~~~~~~~~~(8)$$
接下來我們對式(8)做二項假設:
- 當 $$X_B\ll 1$$ 時,$$\ln(1-X_B)=-X_B$$
- 由於沸點上升的度數 $$\Delta T=T-T_b$$,不至於太大,因此 $$T\approx T_b$$,
所以式(8)可以改寫成
$$\displaystyle X_B=\frac{\Delta H_{vap}\Delta T}{RT^2_b}$$
$$\displaystyle\Delta T=(\frac{RT^2_b}{\Delta H_{vap}})X_B~~~~~~~~~(9)$$
最後設法將 $$X_B$$ 換成重量莫耳濃度($$m_B$$)$$\displaystyle X_B=\frac{n_B}{n_A+n_B}$$
由於 $$n_A\gg n_B$$,所以 $$X_B\approx \frac{n_B}{n_A}$$,$$n_A$$ 為溶劑的莫耳數,若我們取1kg的純溶劑,其克分子量為 $$M$$,則 $$n_B=1kg/M$$(記得此時的克分量亦以公斤為單位),則
$$\displaystyle X_B\approx \frac{n_B}{n_A}=\frac{n_B\times M}{1kg}=m_B\cdot M$$
將上式代入(9)式
$$\displaystyle\Delta T=(\frac{RT^2_bM}{\Delta H_{vap}})B~~~~~~~~~(10)$$
對於同一溶劑而言 $$\frac{RT^2_bM}{\Delta H_{vap}}$$ 為一定值,可以 $$K_b$$ 表示,稱為沸點上升常數,
即成為大家熟悉的沸點上升法公式
$$\Delta T=K_b\cdot m_B~~~~~~~~~(11)$$
二、Kb性質的探討
由公式(10)我們得知 $$K_b=\frac{RT^2_bM}{\Delta H_{vap}}$$,其中 $$M$$ 為溶劑的分子量,$$T_b$$ 為純溶劑的沸點,$$\Delta H_{vap}$$ 為溶劑的莫耳蒸發熱,$$R$$ 為氣體常數,以上這些數值均與溶質無關,即溶液沸點上升常數($$K_b$$)的大小僅和溶劑有關。由式中可看出:
- 溶劑的分子量($$M$$)愈大,所得的 $$K_b$$ 值愈大。
- 由Trouton’s定則(註1)得知 $$\frac{\Delta H_{vap}}{T_b}$$ 為一定值,因此 $$K_b$$ 的大小和 $$T_b$$ 成正比,即沸點愈高的溶劑,其值愈大。
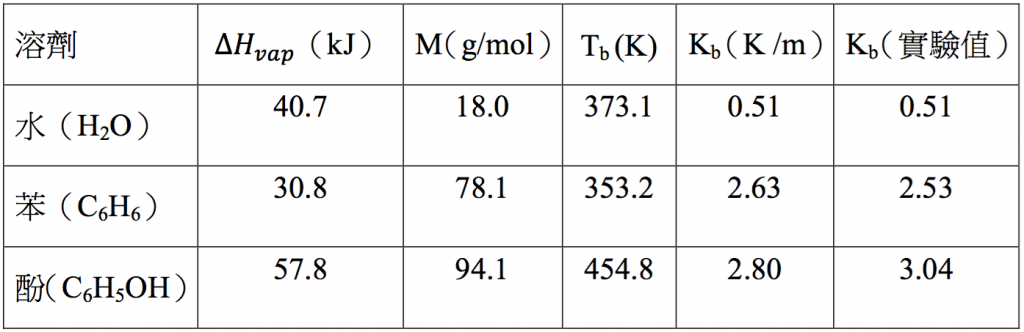
使用沸點上升法求分子量時,$$K_b$$ 值愈大沸點上升的度量愈大,愈容易量測,產生的誤差較小。今以表一不同溶劑的沸點上升常數一覽表中的苯為例,試算其值為:
$$K_b=\displaystyle\frac{RT^2_bM}{\Delta H_{vap}}$$
$$=\displaystyle\frac{8.314~J\cdot mol^{-1}\times (353.2~K)^2\times 78.1\times 10^{-3}~kg\cdot mol^{-1}}{30.8\times 10^3~J\cdot mol^{-1}}=2.63~K/m$$
由上列理論計算所得的數值為 $$2.63$$,和經由實際實驗所得的經驗值 $$2.53$$ 相差無幾。由表中亦可看出,分子量愈小者其 $$K_b$$ 愈小,例如水的分子量 $$18$$,其 $$K_b$$ 值僅為 $$0.51$$。另外,酚的分子量及沸點均高,分別為 $$94.1$$ 及 $$454.8~K$$,其 $$K_b$$ 值則較大為 $$2.80$$。
參考資料
- P. W. Atkins, “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p. 134 (1994).
- 葉名倉,劉如熹,邱智宏,周芳妃,陳建華,陳偉民,高級中學化學選修上冊,南一書局,第140~141頁,2013 年。


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  化學的填字遊戲?
化學的填字遊戲?  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第 

有個地方打錯了喔
在(9)~(10)式間應該是na=1kg/M
寫的很簡單,謝謝你