標準狀態的基準壓力改變時對熱力學數據的影響(一)
標準狀態的基準壓力改變時對熱力學數據的影響(一)
The effect on thermodynamic data when the standard pressure changed(I)
國立臺灣師範大學化學系兼任教師 邱智宏
定義標準狀態 (standard state) 時,首先必須訂定基準壓力,以往的壓力均訂為大家所熟悉的 $$1$$ 大氣壓力 $$(1~atm = 101,325~Pa)$$。但自 1982 年起,國際純化學與應用化學聯合會 (IUPAC) 將其改訂為 $$1~bar (10^5~Pa)$$。其所持的理由為帕 $$(Pa)$$ 為國際標準單位 (SI unit),目前已廣為各國科學界所使用;在處理平衡常數時,常使用到對數的關係式:$$\ln(p/p^0)$$,若 $$p^0=1~bar$$ 時,使用上甚為方便。
然而,在許多化學教科書上,仍沿用舊制,其拒抗的原因除了因循習慣以外,對於初學壓力的學子,一大氣壓相較於 $$1~bar$$ 是一個較為具體、不抽象的概念。可喜的是目前國內的高中化學教科書,自 95 課綱後,已經開始逐漸調整中1。
本文擬探討壓力由 $$1~atm$$ 改為 $$1~bar$$ 時,對於熱力學的數據 (thermodynamic data) 究竟有多大的影響,尤其是查表經常會使用到的 $$\Delta_f H^0$$、$$\Delta_f G^0$$、$$S^\circ$$ 及平衡常數 $$(K)$$ 等數值,並提供它們在二種不同壓力系統間的轉換方法。
一、標準壓力改變對焓、熵及自由能的影響
欲觀察等溫下、壓力改變對焓 (enthalpy, $$H$$)、自由能 (Gibbs free energy, $$G$$) 及熵 (entropy, $$S$$) 的影響,必須從熱力學的基本公式開始推導。
首先討論焓,若經由右列公式:$$dH=TdS+Vdp$$,當溫度為定值時,可知壓力改變對焓的影響:
$$\displaystyle(\frac{\partial H}{\partial p})_T=T(\frac{\partial S}{\partial p})_T+V~~~~~~~~~(1)$$
另外,由麥克斯爾關係式 (Maxwell relation): $$(\frac{\partial S}{\partial p})_T=-(\frac{\partial V}{\partial T})_p $$及體積膨脹係數 (volume expansion coefficient, $$\alpha$$):$$ \alpha=\frac{1}{V}(\frac{\partial V}{\partial T})_p$$,代入 $$(1)$$ 式可得 $$(2)$$ 式如下:
$$\displaystyle(\frac{\partial H}{\partial p})_T=V(1-\alpha T)~~~~~~~~~(2)$$
將 $$\alpha$$ 直接代入右式:$$(\frac{\partial S}{\partial p})_T=-(\frac{\partial V}{\partial T})_p $$,可得熵隨壓力變化的關係式:
$$\displaystyle(\frac{\partial S}{\partial p})_T=-V\alpha~~~~~~~~~(3)$$
由 $$dG=-SdT+VdP$$,可知當 $$T$$ 為定值時,壓力改變對自由能的影響:
$$\displaystyle(\frac{\partial G}{\partial p})_T=V~~~~~~~~~(4)$$
由 $$(2)$$、$$(3)$$、$$(4)$$ 式,可以求出物質由 $$1~atm$$ 降至 $$1~bar$$ 時,焓、自由能及熵的改變量,下列分成氣體和固、液體(凝態)兩部分討論:
(一)理想氣體部分
一般處理熱力學數據時,均將氣體的參考狀態 (reference state) 當做是理想氣體。由於理想氣體的焓僅和溫度有關,因此在恒溫下,改變壓力其數值不變,所以 $$1~bar$$ 時的焓 $$(H^{0,bar})$$ 和 $$1~atm$$ 時的焓 $$(H^{0,atm})$$ 兩者相等。當然經由 $$(2)$$ 式也可導出相同的結果,由理想氣體方程式 $$pV=nRT$$ ,可知:
$$ \alpha=\displaystyle\frac{1}{V}(\frac{\partial V}{\partial T})_p=\displaystyle \frac{1}{V}(\frac{\partial (\frac{nRT}{p})}{\partial T})_p=\frac{nR}{pV}$$
代入 $$(2)$$ 式後再積分,由於為理想氣體其 $$\frac{nRT}{pV}=1 $$,因此積分式內為 $$0$$,結果如下:
$$\displaystyle\int_{1.01325 bar}^{1 bar} dH=H^{0,bar}-H^{0,atm}=\int_{1.01325 bar}^{1 bar} V(1-\frac{nRT}{pV})dp=0$$
$$ H^{0,bar}=H^{0,atm}~~~~~~~~~(5)$$
至於熵的變化,直覺地判斷兩者就不會相等,因為數量相同的氣體分子,在等溫下壓力較小的 $$1~bar$$ 所佔有的體積,自然比 $$1~atm$$ 的多,因此亂度較大。$$1~bar$$ 下的熵 $$(S^{0,bar})$$ 和 $$1~atm$$ 下的熵 $$(S^{0,atm})$$ 之間的差異可由 $$(3)$$ 式求得,每莫耳增加 $$0.1094~J/K$$。
$$\displaystyle\int_{1.01325}^{1 } dS=\int_{1.01325}^{1 }(-V\alpha)dp=\int_{1.01325}^{1 }-\frac{nR}{p}dp=-nR\ln(\frac{1}{1.01325})$$
$$ S^{0,bar}-S^{0,atm}=nR\ln (1.01325)=0.1094n~~~~~~~~~(6)$$
自由能的變化可經由 $$(4)$$ 式中求得:
$$\displaystyle\int_{1.01325}^{1 } dG=\int_{1.01325}^{1 } Vdp=-nRT\ln(1.01325)=-0.1094nT$$
$$ G^{0,bar}-G^{0,atm}=-nRT\ln (1.01325)=-0.1094nT~~~~~~~~~(7)$$
由 $$(7)$$ 式可算出在 $$298.15~K$$ 時,$$1$$ 莫耳氣體當壓力由 $$1~atm$$ 改變為 $$1~bar$$ 後,其自由能的改變 $$(G^{0,bar}-G^{0,atm})$$ 為 $$-3.263\times 10^{-2}~kJ/mol$$。
(二)固、液體部分
由於壓力從 $$1~atm$$ 改變至 $$1~bar$$ 是一個很小的範圍,因此這段區間內,可將 $$\alpha$$、$$V$$ 視為定值,因此上列 $$(2)$$、$$(3)$$、$$(4)$$ 的可分可改寫如下:
$$ H^{0,bar}-H^{0,atm}\approx V(1-\alpha T)\Delta p~~~~~~~~~(8)$$
$$ S^{0,bar}-S^{0,atm}\approx -V\alpha\Delta p~~~~~~~~~(9)$$
$$ G^{0,bar}-G^{0,atm}\approx V\Delta p~~~~~~~~~(10)$$
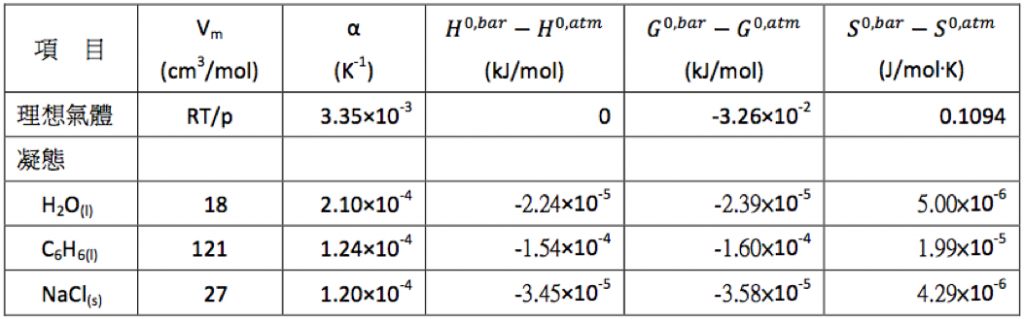
若將純物質的實際數值代入上列各式計算,可得結果如表一,例如 $$\mathrm{H_2O_{(l)}}$$ 的部分:
$$\begin{array}{ll}H^{0,bar}-H^{0,atm}&\approx 18\times 10^{-6} m^3mol^{-1} (1-2.10\times 10^{-4}\times 298.15)(10000-101325)\\ &=-2.24\times 10^{-2} Jmol^{-1}=-2.24\times 10^{-5} kJmol^{-1}\end{array}$$
由表一可看出,在定溫為 $$298.15~K$$ 時,氣態的 $$H^{0,bar}=H^{0,atm}$$,壓力改變對焓没有影響,但對於自能及熵由 $$1~atm$$ 改變為 $$1~bar$$ 時,前者每一莫耳減少 $$0.1094T (3.26\times 10^{-2}~kJ/mol)$$,後者增加 $$0.1094~J/mol\cdot K$$,因此若壓力改變時使用到這些數據,則必須經過適當的調整。
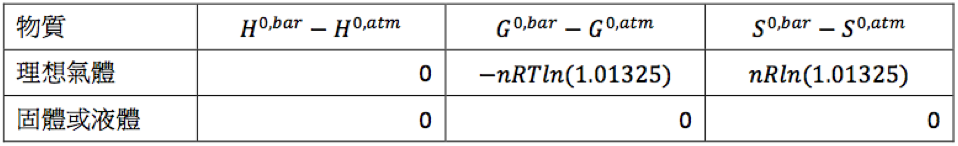
至於凝態的部分,可看出通常以千焦為單位的熵和自由能,$$1~bar$$ 和 $$1~atm$$ 的差別,由表中可看出最大的差異也不會大於 $$0.00016~kJ/mol$$,相較於實際測量時的不準度,兩者幾乎可以看成相等。另外,熵的情況也是相同的情況,兩者的差距均在 $$10^{-5}$$ 到 $$10^{-6}$$ 之間相對於氣體的 $$0.1094~J$$,可以忽略不計。依據上述可將壓力由 $$1~atm$$ 改變成 $$1~bar$$ 時,對焓、自由能及熵的改變整理如表二。
二、壓力改變對莫耳生成焓及莫耳生成自由能的影響
由表二可知,對於固體及液體,其傳統表達的焓 (conventional enthalpy),或稱相對焓、相對自由能及相對熵,當壓力由 $$1~atm$$ 改變成 $$1~bar$$ 時是不需要調整的,除非是進行極精密的檢測。至於氣體除了焓以外,自由能及熵均需經過適當的調整。然而我們平常在查表時,焓及自由能均以莫耳生成焓 (molar enthalpy of formation) 及莫耳生成自由能表示,那麼它們在壓力由 $$1~atm$$ 變成 $$1~bar$$ 時應如何調整?
首先莫耳生成焓的部分不需要調整,原因己如上述,至於熵查表時均以相對熵表示,其調整方式亦如上述,將增大 $$nR\ln(1.01325)$$。最終需要關注的僅為莫耳生成自由能的部分,其調整必需依據生成反應中,各相關物質的狀態加以考量,例如下列水蒸氣及水的莫耳生成自由能的調整就不一樣:
$$H_{2(g)}+\frac{1}{2} O_{2(g)} \rightarrow H_2O_{(g)}~~~~~~~~~(11)$$
$$H_{2(g)}+\frac{1}{2} O_{2(g)} \rightarrow H_2O_{(l)}~~~~~~~~~(12)$$
純物質的標準莫耳生成自由能 $$(\Delta_f G^{0,bar})$$ 即為 $$1~bar$$ 下某特定溫度時,該純物質 $$1$$ 莫耳的自由能減去其各成份元素最穩定狀況的自由能。例如 $$(11)$$ 式之標準莫耳自能可表示如下:
$$\displaystyle\Delta_f G^{0,bar}_{H_2O_{(g)}}=1\times G^{0,bar}_{H_2O_{(g)}}-1\times G^{0,bar}_{H_{2(g)}}-\frac{1}{2}\times G^{0,bar}_{O_{2(g)}}$$
而 $$1~bar$$ 和 $$1~atm$$ 的標準莫耳生成自由能的差別如下:
$$\displaystyle\Delta_f G^{0,bar}_{H_2O_{(g)}}-\Delta_f G^{0,atm}_{H_2O_{(g)}}\\ \quad=1\times (G^{0,bar}_{H_2O_{(g)}}-G^{0,atm}_{H_2O_{(g)}})-1\times (G^{0,bar}_{H_{2(g)}}-G^{0,atm}_{H_{2(g)}})-\frac{1}{2}\times (G^{0,bar}_{O_{2(g)}}-G^{0,atm}_{O_{2(g)}})$$
$$\displaystyle\Delta_f G^{0,bar}_{H_2O_{(g)}}-\Delta_f G^{0,atm}_{H_2O_{(g)}}\\ \quad=1\times (-nRT\ln(1.01325))-1\times(-nRT\ln(1.01325))\\ \quad\quad-\frac{1}{2}\times(-nRT\ln(1.01325))$$
$$\displaystyle\Delta_f G^{0,bar}_{H_2O_{(g)}}-\Delta_f G^{0,atm}_{H_2O_{(g)}}=-\frac{1}{2}\times(-nRT\ln(1.01325))$$
$$\displaystyle\Delta_f G^{0,bar}-\Delta_f G^{0,atm}=\Delta n\times(-nRT\ln(1.01325))~~~~~~~~~(13)$$
上式的 $$\Delta n$$ 等於氣態生成物的總莫耳數減去氣態反應物的總莫耳數,所以 $$(12)$$ 式中生成水的情況,其 $$\Delta n=-1.5$$,有別生成水蒸氣的 $$(11)$$ 式,其 $$\Delta n=-0.5$$。表三是在 $$298.15~K$$、$$1~atm$$ 的條件下,將一些純物質的熱力學數據直接由普化的教科書2擷取,並利用公式 $$(5)$$、$$(6)$$、$$(13)$$ 將標準壓力由 $$1~atm$$ 改變為 $$1~bar$$ 時,其數值的變化情形條例出來。
參考文獻
- 葉名倉,劉如熹,邱智宏,周芳妃,陳建華,陳偉民 (2013 )。高級中學基礎化學(一)。南一書局。第 111~119 頁。
- Birk, J. P. (1994). Chemistry. Appendix C, A12 ~ A19. Houghton Mifflin Company.
- Atkins, P. W. (1994). Physical Chemistry (5th ed.). Data section, C8 ~ C15. Oxford University Press, Oxford.
- Freeman, R. D. (1985). Conversion of Standard Thermodynamic Data to the New Standard-State Pressure. Journal of Chemical Education, 62 (8), 681-686.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(十一):凡人法拉第
化學傳記:法拉第不為人知的一面(十一):凡人法拉第  中間體與穩定狀態近似法
中間體與穩定狀態近似法  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  暖暖包的原理
暖暖包的原理 
