道耳頓分壓定律
道耳頓分壓定律 (Dalton’s law of partial pressures)
國立臺灣師範大學化學系葉名倉教授責任編輯
日常生活中所接觸的氣體大多是混合氣體,例如空氣是成分氣體就包含了氮氣、氧氣、水蒸氣、二氧化碳及惰性氣體等等。在混合氣體中,每種成分氣體都會貢獻了「分壓」(partial pressure),這個分壓即為該氣體單獨存在於與混合氣體相同體積的容器中產生的壓力。
約翰‧道爾頓(John Dalton)在1801年經由實驗證實了氣體的一項重要性質﹕混合氣體產生的總壓力等於混合氣體中各別成分的分壓總合,此發現又稱為道耳頓分壓定律。 道耳頓分壓定律的公式可分別表示如下:
1. Ptotal = Σ Pi or Ptotal = P1 + P2+ …… + Pn 其中P1,P2,Pn為各個個別成分的分壓,並且假定氣體分子間沒有任合作用力。
2. Pi = Ptotal × Mi 其中Mi為成分i在混合氣體中的莫耳分率。
3. 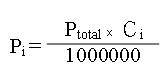
以上的關係式可藉由Pi和Ptotal求出混合氣體中各個個別氣體的體積濃度,其中Ci為成分i的體積濃度(單位:ppm)。
真實氣體並不完全遵守道耳吞分壓定律。在高壓的情況下誤差極大,因為分子本身所佔的體積也是影響壓力的原因之一。再者,若氣體分子間的平均距離很短,將會提高分子間作用力的強度進而改變壓力。真實的氣體,特別是一些非極性或是極性很小的氣體分子,在較低的壓力及較高的溫度(高於沸點溫度)條件之下,也可視為理想氣體。理想氣體不需考慮分子本身的體積及分子間作用力,因而遵守道耳吞分壓定律。
資料來源
Wikipedia


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  化學的填字遊戲?
化學的填字遊戲?  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  暖暖包的原理
暖暖包的原理  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
