氯化鋅(Zinc Chloride)
氯化鋅(Zinc Chloride)
國立臺灣師範大學化學系碩士班二年級江孟潔
氯化鋅的性質
外觀無色或白色晶體,沸點 $$756^\circ C$$ $$(1029~K)$$,熔點 $$275^\circ C$$ $$(548~K)$$,密度 $$2.907~g/cm^3$$,易溶於水,溶於甲醇、乙醇、甘油、丙酮、乙醚,不溶於氨水。無水的氯化鋅受到空氣中的濕氣潮解形成鹽酸,同時也會與水、氨和其他有機溶劑形成複合物離子,鹼性物質在氯化鋅溶液中產生沉澱氫氧化鋅。氯化鋅的性質為路易士酸因此也具有親電性質。1-2
製備
(1) 利用鋅和氯化氫反應,形成無水氯化鋅
(2) 濃鹽酸和鋅(也可以使用氧化鋅或硫化鋅)反應,可形成水合的氯化鋅
用途及應用
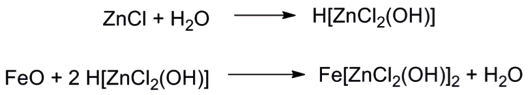
在焊接鐵皮,用氯化鋅溶液清除金屬表面的氧化物,$$\bf{H[ZnCl_2(OH)]}$$ 有顯著酸性能清除金屬表面不損害金屬表面。
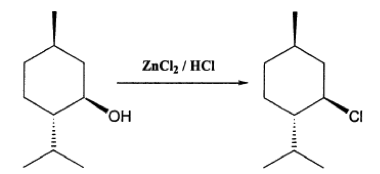
盧卡斯試劑(Lucas reagent)是無水氯化鋅溶於高濃度鹽酸所配製成的一種溶液。這種溶液被用於鑑別低分子量的醇,反應中氯會取代短鏈醇中的羥基,生成不溶於水的氯代烷,呈現沉澱,通過反應的快慢判斷醇的結構。3
ROH + HCl → RCl + H2O
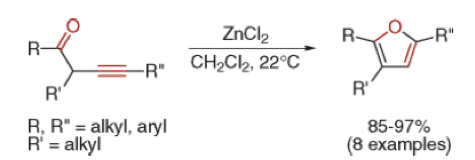
利用氯化鋅為路易士酸在室溫下以二氯甲烷為溶液,透過酮基對炔基進行5-Endo-dig的合環反應。可以高產率的得到呋喃(furan)三取代衍生物,並且具有良好的位置選擇性。4
在1871年阿道夫·馮·貝耶爾(Adolf von Baeyer)首次合成熒光黃,可以從鄰苯二甲酸酐,間苯二酚在氯化鋅的存在下,通過夫[里德耳]-夸[夫特]反應(Friedel-Crafts)反應來製備。1
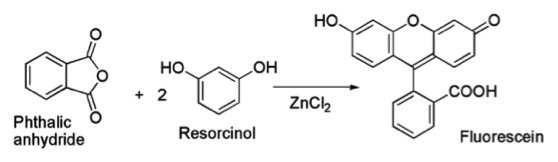
(http://upload.wikimedia.org/wikipedia/commons/thumb/5/5a/ZnCl2_fluorescein.png/480px-ZnCl2_fluorescein.png)
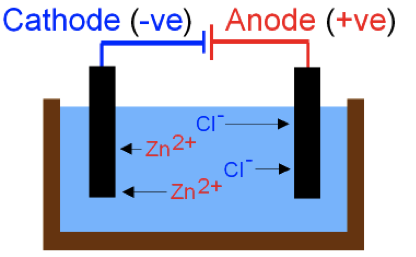
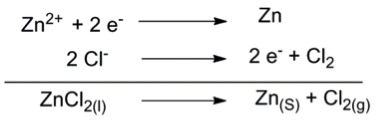
可利用電解氯化鋅,得到鋅金屬和氯氣。
味道控制可以用氯化鋅和硫化物進行反應,降低硫化氫氣體在廢水處理設備中的釋放。乾電池中的氯化鋅當作氯化銨電解液中的吸濕劑,作為腐蝕鋅外殼的阻燃劑。氯化鋅也易吸收活性碳或二氧化矽,藉由Friedel-Crafts反應進行醯化反應和烷化反應;在酯化反應和縮合反應,氯化鋅有利於脫去反應物的水或氨分子,其例子為Fischer indole 合成。
注意事項
氯化鋅毒性很強,能劇烈刺激及燒灼皮膚和粘膜,長期與此藥品產生的蒸氣接觸時,對呼吸道、氣管、支氣管黏膜有損害。保持容器密封,要在有足夠的通風條件下使用。生產人員工作時要穿工作服,戴防護眼鏡、防毒口罩、乳膠手套,以保護皮膚、眼睛、呼吸器官。在接觸的情況下,立即用大量的水沖洗眼睛或皮膚至少15分鐘。
參考資料
- 氯化鋅http://en.wikipedia.org/wiki/Zinc_chloride
- http://www.zaclon.com/pdf/zinc_chloride_sol_and_solid_data.pdf
- Pushpananda A. Senaratne, Felix M. Orihuela, Arcelio J. Malcolm, and Keith G. Anderson, Organic Process Research & Development, 2003, 7, 185
- Adam Sniady, Audrey Durham, Marco S. Morreale, Kraig A. Wheeler, Roman Dembinski, Org. Lett., 2007, 9, 1175



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?
化學傳記:法拉第不為人知的一面(一):時至今日為何重提法拉第?  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  強化玻璃
強化玻璃  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體 
