哈蒙德假說
哈蒙德假說 (Hammond Postulate)
國立臺灣師範大學碩士生二年級陳培杰
一、簡介
在發生化學反應時,由反應物轉變為產物的途中會經過一個過渡狀態,為反應過程中能量的最大值。所以過渡狀態變成產物、或者沿原途徑變回反應物不需要額外增加任何能量就可以達到,而且轉變過程會釋放出能量。哈蒙德假說(Hammond Postulate)則是利用過渡態與反應物和產物的能量關係來推測出該過渡態的狀態與反應物和產物的狀態何者較相似。
二、哈蒙德假說(Hammond Postulate)
在反應過程中,過渡狀態瞬間消失,沒有任何物理技術可以測得過渡狀態。
而化學反應是分子間發生化學鍵的斷裂或生成。因此科學家推論,過渡狀態應該是反應物的化學鍵發生了部分斷裂並且部分形成新的化學鍵擁有產物的特徵,為同時擁有部分反應物與部分產物的中間狀態。
哈蒙德假說:在化學反應中,過渡狀態最像能量跟他接近的穩定物質。
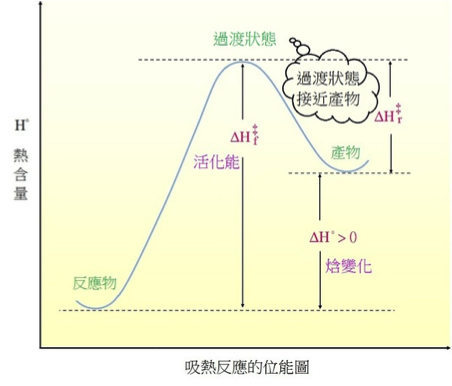
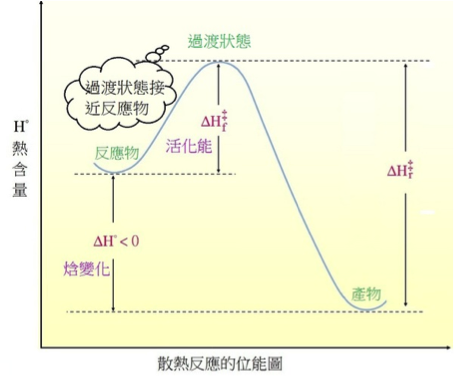
既然說到能量,我們知道化學反應分為吸熱反應與放熱反應兩種。其反應能量圖如下圖:
圖片來源:http://blog.udn.com/Gabriel33/4672144
也就是說,哈蒙德假說認為,在吸熱反應時過渡狀態與產物能量較相近,因此過渡狀態比較像產物而不是反應物,而在放熱反應時,過渡狀態能量與反應物較相近,會比較像反應物。而我們將比較像反應物的過渡狀態稱為「早(early)過渡態」,而把比較像產物的稱為「晚 (late)過渡態」。
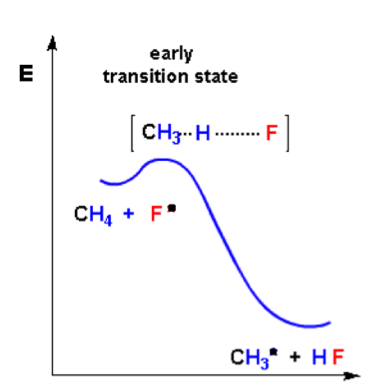
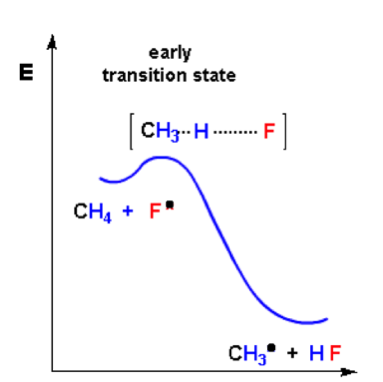
我們舉個例子來說明:當我們以甲烷為反應物進行氟化與碘化反應時,其速率決定步驟分別為放熱與吸熱反應,其能量圖如下:
圖片來源:http://www.chemgapedia.de/
氟化反應為吸熱反應,為「早過渡狀態」,因此其過渡狀態為H-F鍵些微生成,H-C鍵些微斷裂,較具有反應物特徵。而碘化反應為吸熱反應,為”晚過渡狀態”,因此過渡狀態為H-I鍵大部分生成,H-C鍵大部分斷裂,較具有產物特徵。
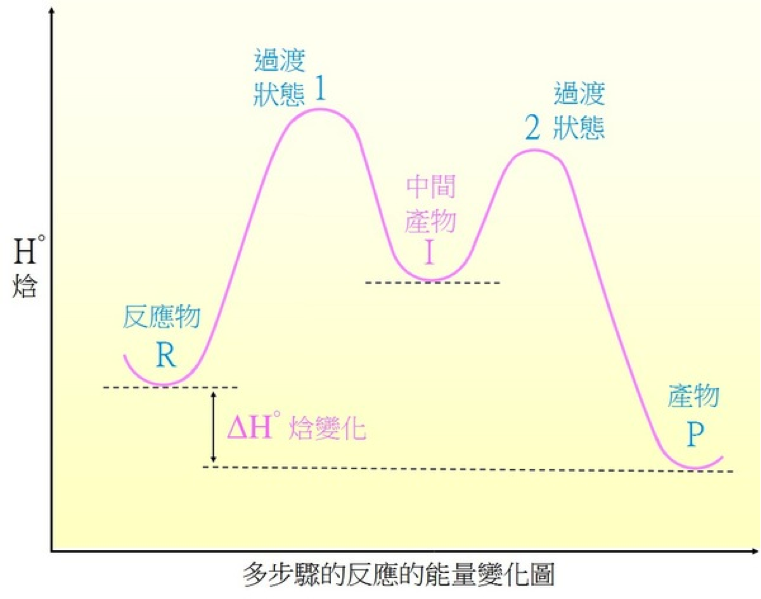
另外,化學反應為多階段反應,具有中間產物時,其能量圖如下:
上圖為二階段反應,可分成R→I與I→P兩個步驟。前半部R→I為吸熱反應,過渡狀態較類似於產物(中間產物),後半部I→P為放熱反應,過渡狀態較類似於反應物(中間產物)。因此,在多階段的化學反應中,「中間產物」最能說明R→P的反應途徑。由於過渡狀態瞬間消失無法利用物理技術測得,因此在二階段反應中,若想要一步步了解反應的過程,最基本地必須先了解「中間產物」,因為這兩個過渡狀態不類似反應物也不類似產物,而是「中間產物」。
參考資料
- L.G. Wade, JR. <<Organic Chemistry>>, 7th edition, p.151.
- 哈蒙德假說http://en.wikipedia.org/wiki/Hammond’s_postulate


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定 
