雙原子氣體的比熱
雙原子氣體的比熱 (Specific heat of diatomic gases)
國立臺灣大學物理系101級 鍾豪
能量均分原理(equipartition principle)是指:「若某分子具有 $$f$$ 種儲存能量的方式,則該分子在溫度為 $$T$$ 時所具有的平均能量為 $$f\times \frac{1}{2}k_BT$$,其中 $$k_B$$ 為波茲曼常數(Boltzmann constant)。」在此,「均分」代表每一種儲存能量的方式互相獨立,且皆帶有 $$\frac{1}{2}k_BT$$ 的平均能量。也因為每一種方式之間互相獨立,所以 $$f$$ 種方式又稱 $$f$$ 個「自由度」。
對於雙原子分子而言,總共有七個自由度,其中三個為移動動能、兩個為轉動動能、兩個為振動動能。在三維空間運動的分子,移動動能可表示為 $$E_{tr}=\frac{1}{2}m\vec{v}^2=\frac{1}{2}mv_x^2+\frac{1}{2}mv_y^2+\frac{1}{2}mv_z^2$$,其中 $$v_x$$、$$v_y$$、$$v_z$$ 為分子分別在 $$x$$ 軸、$$y$$ 軸、$$z$$ 軸的速度分量。而三個速度分量之間互相獨立,因此在移動動能上具有三個自由度。
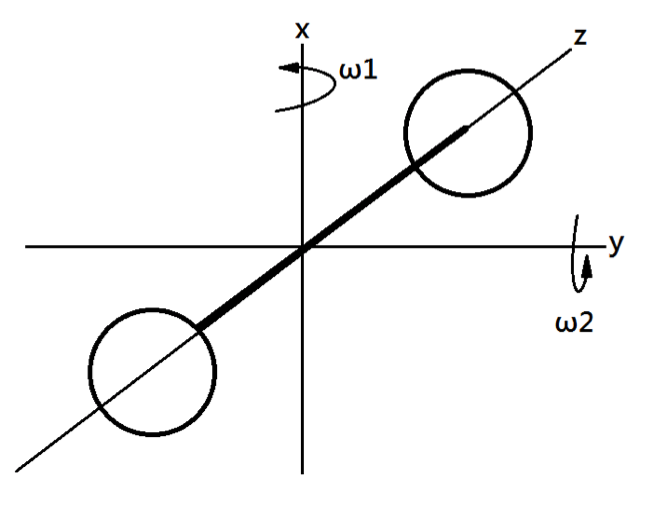
在三維空間中的物體,$$x$$、$$y$$、$$z$$ 三個方向皆有獨立的角速度 $$w_x$$、$$w_y$$、$$w_z$$。
但是,如右圖,對於雙原子分子而言,假設 $$z$$ 軸通過兩原子的質心,則 $$z$$ 軸方向上的轉動慣量 $$I_z$$ 極小,故 $$z$$ 軸方向的轉動動能可忽略。
因此,雙原子分子的轉動動能可表示為 $$E_{rot}=\frac{1}{2}I_x\omega_x^2+\frac{1}{2}I_y\omega_y^2$$,有兩個自由度。
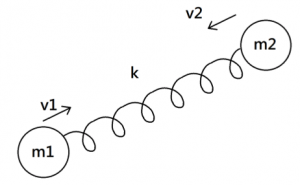
最後是振動動能。兩原子之間的分子鍵可視為一個彈力常數 $$k$$ 的彈簧(如右圖)。
則相對於分子的質心而言(分子為靜止的座標系),兩原子前後振動所具有的動能為 $$\frac{1}{2}\mu(v_1-v_2)^2$$,其中 $$\mu=\frac{m_1m_2}{m_1+m_2}$$ 為等效質量。
而彈簧振動時彈簧本身儲存的位能為 $$\frac{1}{2}kx^2$$,其中 $$x$$ 為彈簧離自然長度的形變量。
因此,振動總能量可表示為 $$E_{vib}=\frac{1}{2}\mu(v_1-v_2)^2+\frac{1}{2}kx^2$$,有兩個自由度。一個雙原子分子能儲存的總能量 $$E_{total}=E_{tr}+E_{rot}+E_{vib}$$,又根據能量均分原理,每個自由度帶有 $$\frac{1}{2}k_BT$$ 的能量,故 $$E_{total}=\frac{7}{2}k_BT$$。
但這七個自由度並非在任何溫度下都會表現出來。在任何大於絕對零度的溫度,移動動能的三個自由度都會表現,但因為量子效應,溫度需大於某個臨界值 $$T_{rot}$$,轉動動能的兩個自由度才會表現。同樣地,溫度需大於 $$T_{vib}$$,振動動能的兩個自由度也才會表現。常見的雙原子分子,$$T_{rot}$$ 大約在 $$10~K(-263^\circ C)$$ 左右,而 $$T_{vib}$$ 則在 $$1000~K$$ 以上。以一氧化碳(CO)為例,$$T_{rot}$$ 為 $$2.8~K$$,$$T_{vib}$$ 則是 $$3080~K$$。
比熱的定義是上升單位溫度所需的能量,在溫度低於$$T_{rot}$$ 時,能量僅能儲存在移動動能的三個自由度當中,此時比熱 $$C=\frac{3}{2}k$$。當溫度超過 $$T_{rot}$$ 但低於 $$T_{vib}$$ 時,能量除了表現在移動動能之外,也能被轉動動能吸收,因此需要提供更多的能量才能提高相同的溫度,此時比熱 $$C=\frac{5}{2}k$$。當溫度超過 $$T_{vib}$$ 時,比熱 $$C=\frac{7}{2}k$$,需要提供最多能量才能提高相同的溫度。
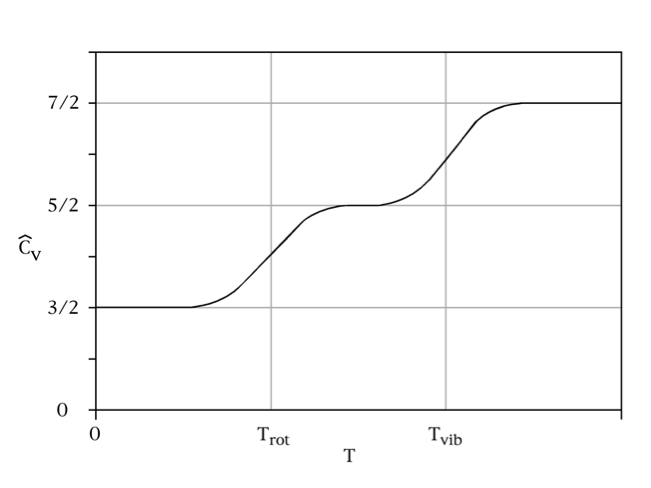
圖三$$~~~$$雙原子分子比熱圖。維基百科。DiatomicSpecHeat1.png。 http://zh.wikipedia.org/wiki/File:DiatomicSpecHeat1.png
對於常見的雙原子分子而言,室溫介於 $$T_{rot}$$ 和 $$T_{vib}$$ 之間,因此實驗測得的比熱為 $$C=\frac{5}{2}k$$,而不是能量均分原理所預測的 $$\frac{7}{2}k$$。馬克士威 (James Clerk Maxwell)在1875年時就發現理論與實驗不相符,但在當時量子論尚未被提出,因此無法完善解釋這個現象。直到1901年,普朗克 (Max Planck)為了解釋黑體輻射而提出量子理論,雙原子分子的比熱問題之後也獲得解決。
事實上,除了移動、轉動、振動三種儲存能量的方式之外,電子在不同能階之間也能儲存能量。但這個效應必需在極高溫才會表現,以氫氣$$(\mathrm{H_2})$$為例,需超過 $$120000~K$$ 時才會有此現象。因此,除了少數領域(如天文物理)外,仍將雙原子分子視為具有七個自由度。
參考文獻
- 維基百科.能量均分定理
http://zh.wikipedia.org/wiki/%E8%83%BD%E9%87%8F%E5%9D%87%E5%88%86%E5%AE%9A%E7%90%86 - Carter A. H.(2001), Classical and statistical thermodynamics, Prentice Hall.
- Blundell S. J., Blundell K. M.(2009), Concepts in Thermal Physics, 2th, Oxford.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  【2013諾貝爾獎特別報導】物理獎:終於,來到了!
【2013諾貝爾獎特別報導】物理獎:終於,來到了! ![[講座] 2016春季展望─天文宇宙大發現](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/03/lec.png) [講座] 2016春季展望─天文宇宙大發現
[講座] 2016春季展望─天文宇宙大發現  【2014諾貝爾物理獎】照亮世界的嶄新光芒
【2014諾貝爾物理獎】照亮世界的嶄新光芒 ![[影音] 梶田隆章:「重力波偵測-The KAGRA project」講座](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/12/2015456121235745.png) [影音] 梶田隆章:「重力波偵測-The KAGRA project」講座
[影音] 梶田隆章:「重力波偵測-The KAGRA project」講座 ![[影音] CASE【百秒說科學】 微中子系列](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/01/pp1268545.png) [影音] CASE【百秒說科學】 微中子系列
[影音] CASE【百秒說科學】 微中子系列  【特別報導】2013年諾貝爾獎預測(二)物理獎
【特別報導】2013年諾貝爾獎預測(二)物理獎  維恩位移定律
維恩位移定律 
