為什麼保溫瓶要抽真空?
為什麼保溫瓶要抽真空? (How vacuum helps thermos do their job)
國立臺灣大學物理系二年級101級 曾奕晴
保溫杯的主要功能,顧名思義,就是將瓶中的承裝物體維持在一定的溫度,也就是盡量避免保溫瓶中的物體和外界產生熱平衡的熱量交換現象。
想要達到恆溫的效果,就要盡量避免瓶中的物體與外界進行熱量的交換。熱的傳播途徑有三種,分別是對流、傳導及輻射,而將保溫瓶內外雙層抽真空,主要是要阻絕熱量藉由傳導的方式和外界進行交換。以下就是要說明,究竟我們是如何藉由抽真空來阻絕熱量藉由傳導作用而散失。
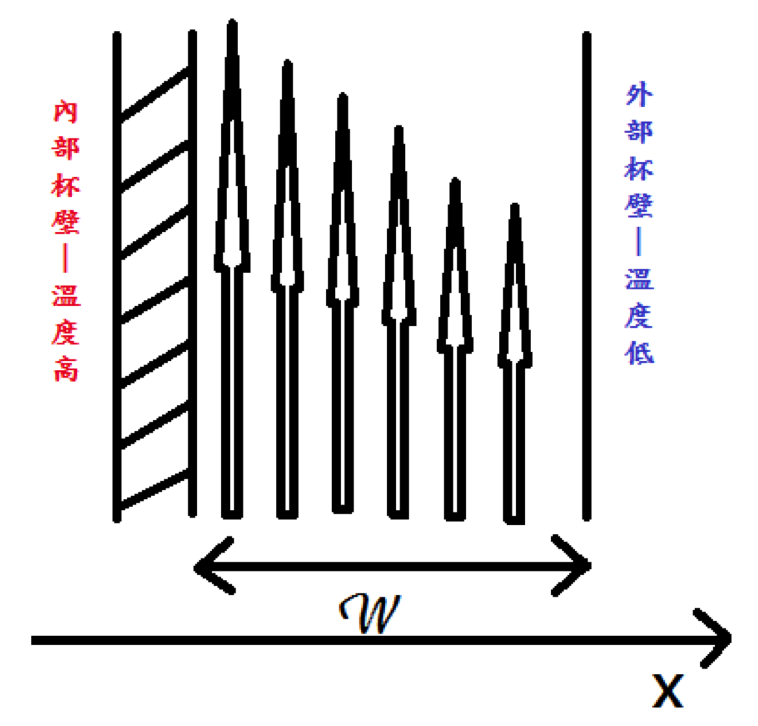
首先我們先架構一個模型,將保溫瓶真空層部分的空氣垂直的切割成一層一層,假設每一層的空氣分子具有的溫度相同,也就是同一層分子中的每個分子具有的動能相同,如下圖(一)。
以箭頭長度表示該層空氣能量高低,假設 \(W\) 為夾層寬度;\(C\) 為夾層中氣體熱容量;\(T\) 為氣體溫度;\(x\) 為由內部指向外部的橫向長度;\(\rho\) 為氣體分子的分子數密度;\(l\) 為氣體在該溫壓下的平均自由徑(註一);\(v\) 為氣體在 \(x\) 方向的速度;\(\rho\) 為分子碰撞截面積。
我們假設一層一層氣體之間的熱通量(單位面積單位時間內所通過的熱量)為 \(H\),因為熱傳正比於溫度梯度,故可列出:
\(H=\displaystyle K\frac{\partial (T)}{\partial x}\) (式一),\(K\):熱傳導係數
我們也可以將熱通量以各變數表示,即:
\(H=(\displaystyle\frac{\partial(CT)}{\partial x}\times l)\rho(v\times \Delta t)A/(A\times \Delta t)\)
\((\frac{\partial(CT)}{\partial x}\times l)\) 為單一分子移動一個平均自由徑後所傳遞的熱能,\((\rho(v\times \Delta t)A)\) 為面積 \(A\) 乘上分子速度 \(v\) 走過時間 \(\Delta t\) 所形成的體積,乘上密度即為此體積所包含的所有分子數量,最後除以面積及時間是為了計算單位時間及單位面積的通量,消去可得:
\(H=(\frac{\partial(CT)}{\partial x}\times l)\times \rho \times v=(C\times l\times \rho \times v)\times \frac{\partial (T)}{\partial x}\) (式二)
由式一和式二比較可得:\(K=C\times l\times \rho\times v=C\times v/\rho\)(註二)
經由以上計算,我們很驚訝地發現:熱傳導係數 \(K\) 竟然與氣體的密度 \(\rho\) 無關!既然如此,那把夾層中的氣體抽真空似乎就沒有意義了!這是怎麼一回事呢?
這個謎團的解答在於:如果我們將夾層抽得「很真空」,那麼以上的估算方式便得修正,而修正後的答案是:熱傳導係數 \(K\) 在氣體很稀薄時其實是與氣體的密度 \(\rho\) 成正比,所以抽真空對於隔熱真的有好處!以下是更仔細的說明。
當夾層的寬度 \(W\) 小於氣體的平均自由徑時,平均而言,氣體分子自內壁跑到外壁前不再有機會與別的氣體分子碰撞,所以它會直接將多餘的熱量丟給外壁,所以計算熱通量的公式就要改寫,變成:
\(H=(\frac{\partial(CT)}{\partial x}\times W)\rho(v\times \Delta t)A/(A\times \Delta t)=(C\times W\times \rho\times v)\times \frac{\partial (T)}{\partial x}\)(式三)
由式三與式一比較可得:\(K=C\times W\times\rho\times{v}\)
此時若其他變數固定,則 \(K\propto \rho\)!!
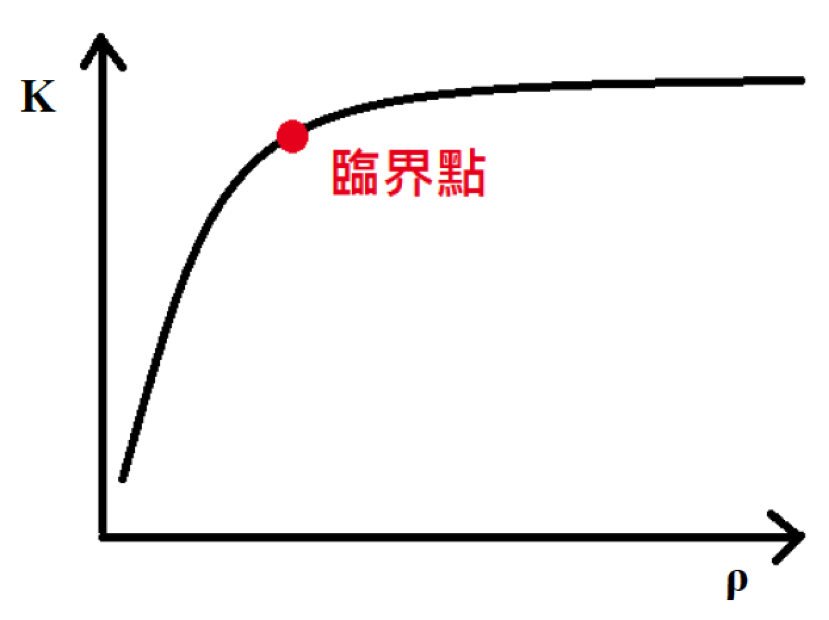
這個改變主要的關鍵就是要讓夾層的寬度小於分子的平均自由徑,只要寬度小於平均自由徑,熱傳導係數就會隨著密度的減小而降低,而平均自由徑和氣體壓力成反比,隨著將氣壓降低、平均自由半徑上升到一個臨界點,也就是開始大於夾層寬度時,熱傳導係數就會開始隨壓力下降而下降。可見圖二。
故我們要盡量將夾層中抽真空,以有效減少夾層中氣體的導熱係數。
註一:氣體的平均自由徑 (Mean free path)指的是氣體分子在兩次碰撞之間所經過的路程統計平均值。假設 \(v\) 為氣體平均速度;\(\rho\) 為氣體分子的分子數密度;\(\sigma\) 為分子碰撞截面。假設為同種氣體分子時,其平均自由半徑 \(l=\frac{1}{\sqrt{2}\rho\sigma}\),應用理想氣體方程式,可推得 \(l=\frac{K_BT}{\sigma p}\),其中 \(p\) 為氣體壓力,\(K_B\) 為波茲曼常數。
例如,在 \(20^\circ C\) 下、標準大氣壓(\(101~KPa\))下,氮氣分子的平均自由徑約為 \(60\) 奈米。
註二:\((l\times \rho = 1/\sigma)\rightarrow\)分子碰撞截面與平均自由徑形成的空間內包含一個分子。
參考文獻
維基百科,平均自由徑http://zh.wikipedia.org/wiki/%E5%B9%B3%E5%9D%87%E8%87%AA%E7%94%B1%E7%A8%8B


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2015年諾貝爾物理獎】粒子世界中的「變態」現象
【2015年諾貝爾物理獎】粒子世界中的「變態」現象  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應 ![[講座] 2016春季展望─天文宇宙大發現](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/03/lec.png) [講座] 2016春季展望─天文宇宙大發現
[講座] 2016春季展望─天文宇宙大發現 ![[課程] VPhysics Python 於物理上之應用](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/07/V物理.png) [課程] VPhysics Python 於物理上之應用
[課程] VPhysics Python 於物理上之應用 ![[影音] 丁肇中諾貝爾物理獎40周年大師演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/06/banner-online.jpg) [影音] 丁肇中諾貝爾物理獎40周年大師演講
[影音] 丁肇中諾貝爾物理獎40周年大師演講 ![[講座] 物理大師演講─楊振寧](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/02/yang_banner_620x280.jpg) [講座] 物理大師演講─楊振寧
[講座] 物理大師演講─楊振寧 ![[影音] CASE【百秒說科學】《改變時空形狀的重力波》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/12/Online-620x280.jpg) [影音] CASE【百秒說科學】《改變時空形狀的重力波》
[影音] CASE【百秒說科學】《改變時空形狀的重力波》  【特別報導】2013年諾貝爾獎預測(二)物理獎
【特別報導】2013年諾貝爾獎預測(二)物理獎 
