熱力學第二定律的各個面相(二)
熱力學第二定律的各個面相(二)
The different viewpoints about the second law of thermodynamic (II)
國立臺灣師範大學化學系兼任教師 邱智宏
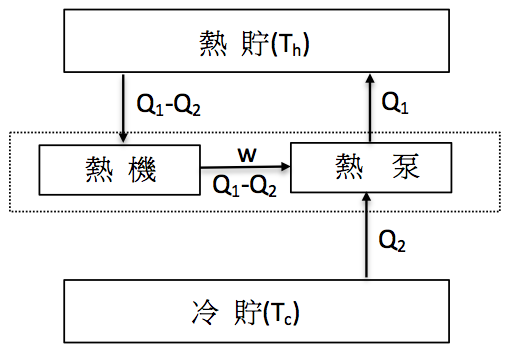
接者我們以圖解的方式來驗證違反凱文-普朗克的說法,是不是也同時違反克勞修斯的說法。首先我們假設有一部違反熱力學第二定律的熱機,能將熱貯所吸取的熱量$$(Q_1-Q_2)$$,並完全對外做功$$(w)$$,不需對冷貯排熱,其裝置詳如圖二的左半部。
此時將一正常的熱泵和熱機連動裝在相同的冷、熱貯之間,其於冷貯中吸熱 $$Q_2$$,由熱機對其做功 $$w$$(也等於 $$Q_1-Q_2$$),並向熱貯排放熱量 $$Q_1$$,其裝置如圖二右半部。若將圖二中的虛線框框當做一個大的熱泵,則可看出整個循環的淨效果等於在熱貯增加 $$Q_2$$ 的熱量,相當於有 $$Q_2$$ 的熱量自發性的由冷貯流向熱貯,此結果即違反克勞修斯的說法,因此此二種熱力學第二定律的說法乃異曲同功。
三、熵與凱文-普朗克二種說法的等價性
熱力學第二定律的第三種說法為:$$\Delta S_{univ}\ge 0$$,此一說法其實和上二種說法也是相同的。首先幾乎所有物理化學的教科書在推導 $$\Delta S_{univ}\ge 0$$ 時,其中一個關鍵的步驟,即為若 $$\Delta S_{univ}< 0$$ 則會導致違反凱文-普朗克的說法,於是 $$\Delta S_{univ}$$ 必須大於等於 $$0$$。
由於書中推導甚詳,為了簡明起見不再贅敘,現在我們只要證明違反凱文-普朗克的說法,即會違反熵的說法,即能證明二者的等價性。假設類似圖二中左側的熱機,能從溫度固定為 $$T_h$$ 的熱貯吸熱 $$Q$$,並將其完全轉換為功,無需對冷貯排熱,此熱機顯然違反凱文-普朗克的說法。此時熱貯的流出熱量 $$Q$$,其減少的熵為 $$\frac{Q}{T_h}$$,而冷貯没有熵的變化,因此整體熵的變化:$$\Delta S_{univ}=-\frac{Q}{T_h}<0$$,即違反熵的說法,因此二種說法為等價。
四、結論
以上的說明,雖然只推論克勞修斯與凱文-普朗克二種說法具有等價性,及熵與凱文-普朗克二種說法各具有等價性,其實由邏輯的關係即可推論,熵與克勞修斯的二種說法亦具有等價性,因此這三種說法誠為一體的數個面相。
一般教科書將前二種說法作為歷史性的介紹,而第三種說法則著墨甚多,其主要原因為熵為狀態函數,有多種不同定量的數學表示法,而且能預測反應移動的方向,在化學領域中佔有重要的地位。學子往往一頭鑽入各種狀況中熵的計算,及公式的推導及換算,卻忽略此三者歷史傳承的意義及互為一體的事實。
參考文獻
- Levine, I. N. (2009), Physical Chemistry (6th ed.). p93~96, McGRAW-HILL Book Company.
- Atkins, P. W. (1994), Physical Chemistry (5th ed.). p127~138, Oxford University Press, Oxford.
- 5.1 Concept and Statements of the Second Law (Why do we need a second law?) — MIT. http://web.mit.edu/16.unified/www/FALL/thermodynamics/notes/node37.html
- MAE 431: ENERGY SYSTEM — State University of New York at Buffalo, http://www.eng.buffalo.edu/~llee3/Projects/LengFengLee_MAE431ResearchPaper.pdf


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  中間體與穩定狀態近似法
中間體與穩定狀態近似法  暖暖包的原理
暖暖包的原理  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中 
