氫原子光譜系
氫原子光譜系 (Hydrogen Spectral Series)
國立臺灣大學物理學系 簡嘉泓
歷史
19 世紀中期,由於光譜學的發展及測量技術的演進,人們發現熱的稀薄氣體隨著種類的不同,會產生不同波長的發射譜線,而元素態的氫原子光譜也是在這個時間點被發現。
1885 年,瑞士數學教師約翰・雅各布・巴耳末 (J. J. Balmer) 運用了瑞典科學家安德斯・埃格斯特朗 (A. J. Ångström) 對氫原子光譜的精確測量結果,針對四條可見光波段的氫原子光譜(即 $$H_\alpha$$、$$H_\beta$$、$$H_\gamma$$、$$H_\delta$$),推導出奠基於實驗數據的巴耳末公式,描述波長 $$\lambda$$ 的共同規則,隨後更計算 10 條紫外光波段的譜線,亦得到與實驗幾乎相同的結果,人們為紀念其貢獻,將該系列光譜稱為巴耳末系 (Balmer series)。
$$\displaystyle\lambda=B\frac{n^2}{n^2-4}$$
$$n=3,4,5,\cdots,B=3.65\times 10^{-7}(m)$$
1888 年,雷德堡 (Johannes Rydberg) 將巴耳末公式一般化,並預測了其他線系的存在,也使此公式適用於所有的氫光譜線系,並運用倒數關係將公式簡化為:
$$\displaystyle\frac{1}{\lambda}=R\left(\frac{1}{n^2}-\frac{1}{n’^2}\right)$$
$$(n’>n$$,$$n,n’\in\mathbb{N}$$,$$R$$ 為雷德堡常數,$$R=1.09\times 10^{-7})$$
(巴耳末系為 $$n=2$$ 的特例)
其後,波耳(Neils Bohr) 於 1913 年對此光譜提出了解釋,不同的線系也陸續被發現。
原理
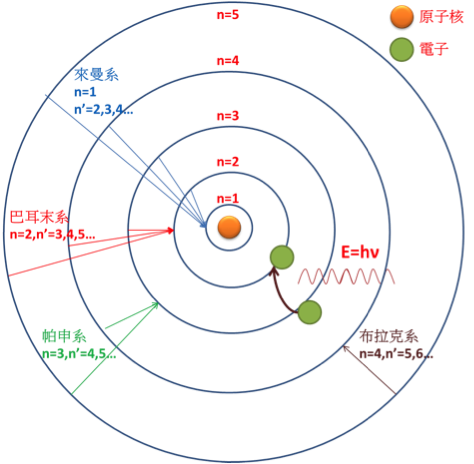
波耳模型指出,原子中的電子僅能存在於特定的能量狀態中,這些特定的能量狀態,稱為原子能階,不同能階中的電子透過輻射光或吸收光移動至不同能階,這些能階間的躍遷所輻射出的特定頻率的光,有能量差 $$E = h\nu$$($$h$$ 為普朗克常數,$$\nu$$ 為光的頻率)之關係,由於雷德堡公式中,對於每一個 $$n$$ 都有 $$n’ = n+1,n+2,n+3,\cdots$$,每種 $$n$$ 和 $$n’$$ 的組合都代表一條譜線。
線系
在雷德堡公式中,每個 $$n$$ 值都有一對應的線系(如 $$n = 1$$ 對應到來曼系,$$n = 2$$ 對應到巴耳末系),線系中頻率最低者 $$(n’=n+1)$$ 為該線系中的 $$\alpha$$ 線,次低者為 $$\beta$$ 線,依此類推……,而每一線系隨著 $$n’$$ 變大,譜線間距會越來越小,直到趨近於 $$\lambda=\frac{R}{n^2}$$,稱為該系的線系限。
來曼系 (Lyman series):從 $$n’= 2,3,4,\cdots$$ 的能階躍遷至 $$n=1$$ 的線系,位於紫外光波段,是在 1906 年由美國的來曼發現的,最低頻率 Lyman-α $$(n’=2)$$ 為 121.57 nm,線系限為 91 nm。
巴耳末系:從 $$n’=3,4,5,\cdots$$ 的能階躍遷至 $$n = 2$$ 的線系,也是唯一位於可見光波段中的線系,也因此首先被發現,在多波段天文學蓬勃發展之前扮演重要的角色,人們可以藉由星體所發出的巴耳末系譜線,測量其表面溫度、磁場以及該處環境的溫度與氫原子的密度等資訊,也為最早的太陽光譜分析提供了重要的數據。
帕申系 (Paschen series):從 $$n’=4,5,\cdots$$ 的能階躍遷至 $$n=3$$ 的線系,由德國物理學家帕申 (Friedrich Paschen) 於 1908 年發現,與之後的線系(布拉格系)有重疊,帕申系及之後的線系皆位於紅外線波段,帕申系之後尚有 $$n=4$$ 的布拉格系 (Brackett series)、$$n=5$$ 的蒲芬德系 (Pfund series)、$$n=6$$ 的韓福瑞系 (Humphreys series) 等。
21 公分線與超精細結構:在量子物理中,將氫原子核自旋與電子自旋所產生的交互作用納入考量,可推得在原子內部的電磁場下,不同方向的電子自旋會使原子有不同的能階,若處於基態的氫原子 (1s) 的兩能階間發生躍遷,就會放出波長 21 公分左右的譜線,屬於微波範圍,這個譜線在無線電天文學中被廣泛應用,因為此波長能穿越星際物質而幾乎不被干擾,使人們透過該波段觀測更加遠處的目標。
參考文獻
- A Brief (Incomplete) History of Light and Spectra – ChemTeam. http://www.chemteam.info/Electrons/Spectrum-History.html
- Bohr model – Wikipedia.https://en.wikipedia.org/wiki/Bohr_model
- hydrogen spectral series – Wikipedia.https://en.wikipedia.org/wiki/Hydrogen_spectral_series
- Rydberg formula – Wikipedia. https://en.wikipedia.org/wiki/Rydberg_formula
- Anders Jonas Ångström – Wikipedia. https://en.wikipedia.org/wiki/Anders_Jonas_%C3%85ngstr%C3%B6m



 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[影音] CASE【百秒說科學】《改變時空形狀的重力波》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/12/Online-620x280.jpg) [影音] CASE【百秒說科學】《改變時空形狀的重力波》
[影音] CASE【百秒說科學】《改變時空形狀的重力波》  維恩位移定律
維恩位移定律  斯特凡-波茲曼定律
斯特凡-波茲曼定律  【丁肇中獲頒諾貝爾物理獎40週年專題】丁肇中院士介紹
【丁肇中獲頒諾貝爾物理獎40週年專題】丁肇中院士介紹 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  【特別報導】2013年諾貝爾獎預測(二)物理獎
【特別報導】2013年諾貝爾獎預測(二)物理獎  霍爾效應
霍爾效應 
