分子間作用力
分子間作用力 (Intermolecular force)
國立臺灣師範大學化學系碩士班二年級郭修甫
從微觀的分子世界來看,分子不斷的運動,但其彼此間存在著某些吸引或排斥的力量。由荷蘭物理學家約翰內斯•凡得瓦(Johannes van der Waals)所發現,因此又名凡得瓦力(Van der waals force)。
凡德瓦力(Van der waals force)有三種不同類型,依照分子的極性不同可分為:
1. 偶極-偶極力(dipole-dipole interaction)
2. 偶極-誘導偶極力(dipole-induced dipole interaction)
3. 倫敦分散力(London dispersion force)
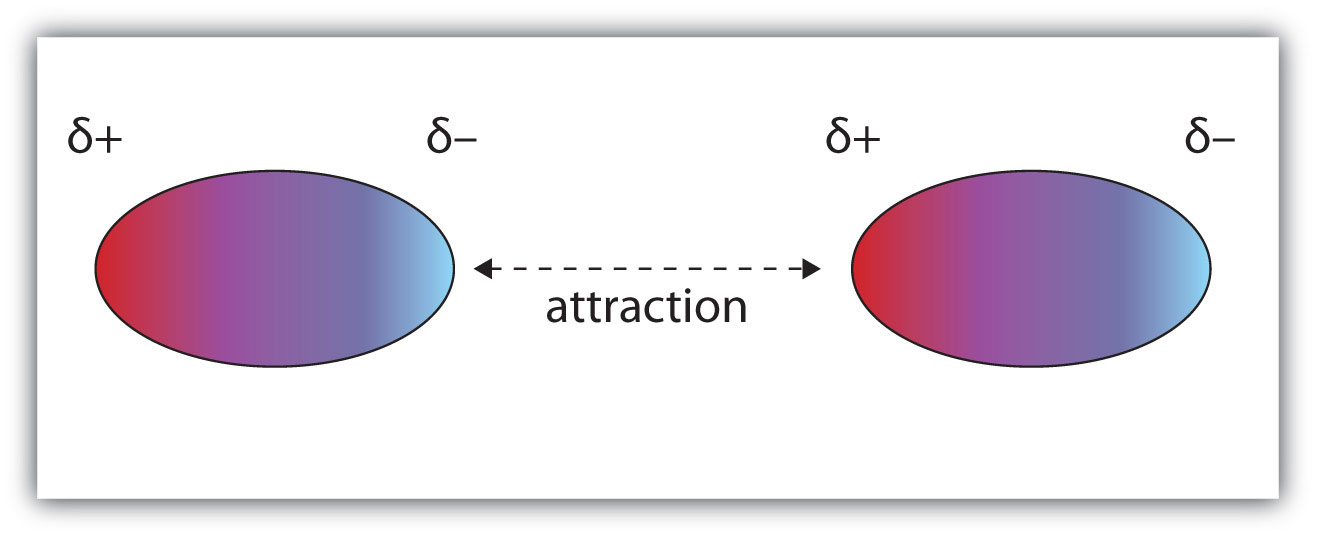
偶極-偶極力(dipole-dipole interaction):
偶極-偶極力為極性分子與極性分子間的作用力,因極性分子的合偶極矩>0,會造成分子內的電荷分布不均而形成永久偶極產生正負端,由此正負端所形成的靜電作用力即為偶極-偶極力。
偶極-誘導偶極力(dipole-induced dipole interaction):
極性分子與非極性分子互相靠近時,極性分子的永久偶極所形成的正負電荷端會極化鄰近的非極性分子,使非極性分子產生臨時偶極也形成正負端,此兩個正負端之間的靜電吸引力即為偶極-誘導偶極力。
倫敦分散力(London dispersion force):
倫敦分散力又稱誘導偶極-誘導偶極力,由於電子不斷運動,一個分子會在某些時刻造成電荷分布不對稱而形成一個「瞬間」微弱的偶極矩,造成微弱的正負端而彼此互相吸引。倫敦分散力為一個臨時的吸引力,非常微弱,但卻是鈍氣依然能在低溫下液化的最大原因。所有分子之間無論是極性分子還是非極性分子都具有分散力的存在。分散力的強度與分子大小與形狀有關。

圖片來源:http://www.tutorhelpdesk.com/homeworkhelp/Chemistry-/Classification-Of-Crystalline-Solids-Assignment-Help.html
綜合以上論述,決定凡德瓦力大小的因素為:
- 分子極性:分子量相近時,極性分子造成的有極矩較大,凡德瓦力較大。
- 分子大小:分子(分子量)越大所含的電子數越多,其凡德瓦引力越大。
- 分子形狀:分子形狀越不對稱,出現電子分布不均的機率較大,其凡德瓦力越大。
氫鍵(Hydrogen bond)
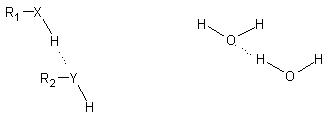
在某些特殊的分子中,存在著氫鍵,屬於一種永久偶極的分子間作用力。氫鍵發生在已經以共價鍵與其他原子鍵結的氫原子與另一原子之間(X-H…Y),通常氫鍵作用時氫原子兩邊的原子有較強的電負度(F、O、N),使其端帶部分負電荷,而氫端帶部分正電荷,帶有部分正電的氫能吸引鄰近電負度較大的F、O、N上的孤對電子而形成氫鍵。
氫鍵表示法:
其中, X屬於電負度大的原子(如F、O、N),Y必須具有未共用電子對。
氫鍵的特性:
- 氫鍵具有方向性。
- 分子間若能形成氫鍵者,其熔點、沸點會較高。
- 溶質與溶劑間易形成氫鍵者,溶解度較大(同類互溶)。
- 液體分子間若有氫鍵形成,則分子間作用力增大,其黏度較大。
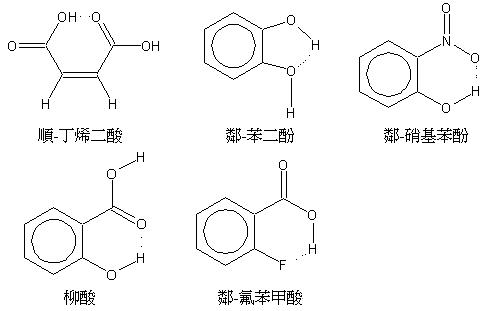
分子內氫鍵:
有些分子結構其原子排列恰巧適合使氫件發生在本身分子內部,則形成分子內氫鍵。通常發生在五邊形或六邊形的分子最適合,且盡量在同平面上。分子內的氫鍵可使分子更穩定地存在。
參考資料
- http://en.wikipedia.org/wiki/Van_der_Waals_force
- http://content.edu.tw/senior/chemistry/tp_sc/content1/number3/2/10-6.htm
- http://en.wikipedia.org/wiki/Intermolecular_force
- http://www.ch.ntu.edu.tw/~gcuni90/lifesci/bullte/interaction.htm
- http://www.chem.purdue.edu/gchelp/liquids/disperse.html
- http://content.edu.tw/senior/chemistry/tp_sc/content1/number3/2/10-5.htm


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  化學傳記:法拉第不為人知的一面(二):從裝訂工變成大學者
化學傳記:法拉第不為人知的一面(二):從裝訂工變成大學者  強化玻璃
強化玻璃  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能 
