鹵化銀(一)
鹵化銀(一)Silver Halide(I)
國立臺灣師範大學附屬高級中學 蔡韶恬
鹵化銀是銀金屬與鹵素結合形成的離子化合物,包括氯化銀 $$\mathrm{(AgCl)}$$、溴化銀 $$\mathrm{(AgBr)}$$、碘化銀 $$\mathrm{(AgI)}$$ 及三種型態的銀氟化物。鹵化銀是照相底片及相紙上使用的感光物質,大部分的鹵化銀中的銀離子為 $$+1$$ 價,然而也有 $$+2$$ 價,目前已知 $$+2$$ 價能穩定存在者只有二氟化銀 $$\mathrm{(AgF_2)}$$。
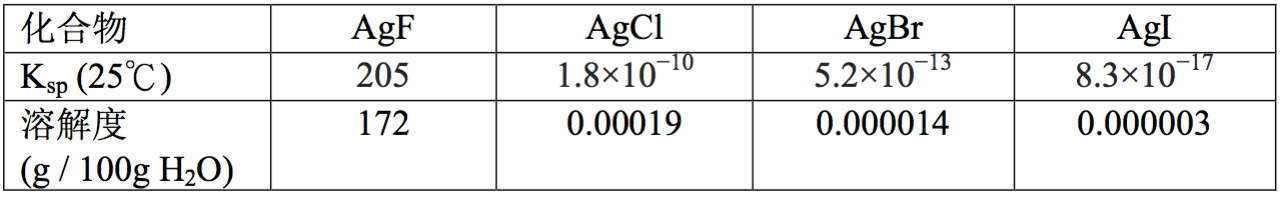
鹵化銀中除了氟化銀之外,均難溶於水。鹵化銀在水中的溶解度差異與鹵素離子的水合能有關,氟離子有極大的水合能,使其在水中的溶解度大約是碘化銀的 $$6\times 10^7$$ 倍。
鹵化銀化合物顏色有明顯區別,由此可迅速辨別溶液中的鹵素離子。硝酸銀可使氯、溴、碘三種鹵素離子沉澱,可藉此定量分析鹵素離子。然而進行這類檢測時須特別留意,待測溶液中某些化合物的存在可能提高或降低鹵化銀的溶解度。會提高鹵化銀溶解度的物質有:氰化物、硫氰化物、硫代硫酸鹽、硫脲、胺類、銨鹽、亞硫酸鹽、硫醚、冠醚等。其他含氮的有機物及硫醇等則會降低鹵化銀的溶解度。(表一)
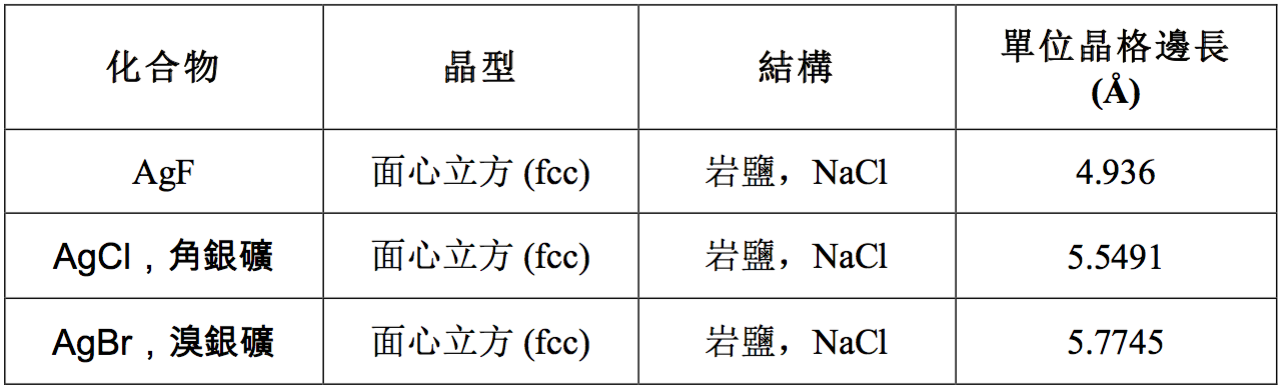
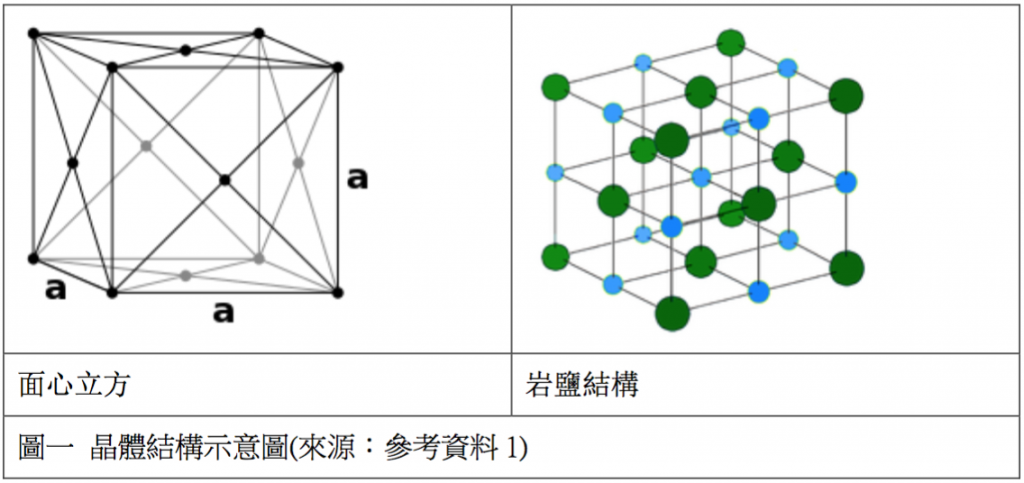
氟化銀、氯化銀及溴化銀都具有面心立方的岩鹽(氯化鈉)晶體結構,如下表所示。其中溴化銀為面心立方堆積,有些出乎意料,一般會認為溴離子與銀離子的半徑比太大,應該較可能形成線性、三配位或四配位的複合體。碘銀礦(碘化銀)的結構與其他鹵化銀明顯不同,屬於六角柱型的紅鋅礦 (zincite) 結構。(表二)
氟化銀 $$\mathrm{(AgF)}$$
性質:
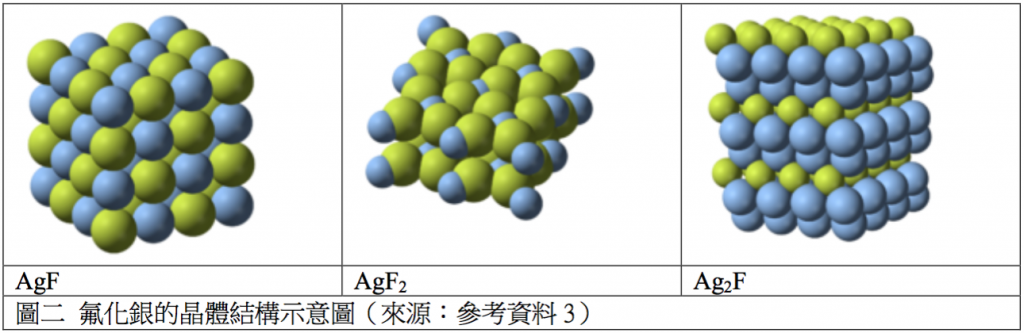
銀與氟兩元素能形成的化合物主要有三種,分別是:氟化銀(I) $$\mathrm{(AgF)}$$、氟化銀(II) $$\mathrm{(AgF_2)}$$、氟化二銀 $$\mathrm{(Ag_2F)}$$,其中最普遍的是氟化銀(I),外觀為黃棕色固體,熔點 $$435^\circ C$$,其水合物為無色,無水固體則為黃色。
光敏性 (Photosensitivity):
不同於其他鹵化銀,無水氟化銀(I) 不具明顯的光敏性,但其二水合物則有光敏性,也因此氟化銀很少被應用在攝影材料上。
製備:
將碳酸銀在氟化氫的環境、白金試管中加熱到 $$310^\circ C$$ 分解可得到高純度的氟化銀(I):
$$\mathrm{Ag_2CO_3+2HF}\overset{\Delta}{\longrightarrow}\mathrm{2AgF+H_2O+CO_2}$$
實驗室的製備方法須避免使用氟化氫,可將四氟化硼銀 $$\mathrm{(AgBF_4)}$$ 熱分解而得:
$$\mathrm{AgBF_4}\overset{\Delta}{\longrightarrow}\mathrm{AgF+BF_3}$$
另一個製備方法是將氧化銀溶於濃氫氟酸中,加入丙酮使氟化銀(I) 沉澱後分離。
$$\mathrm{Ag_2O+2HF}{\longrightarrow}\mathrm{2AgF+H_2O}$$
氟化銀(I) 極易溶於水,溶解度可達 $$1800~g/L$$,甚至可溶解在乙腈中,這點與其他鹵化銀大相逕庭。當它在水溶液中形成沉澱時,是形成氟化銀水合物,如 $$\mathrm{AgF(H_2O)_2}$$ 及 $$\mathrm{AgF(H_2O)_4}$$。這點在銀(I) 的化合物及鹵化銀當中是非常獨特的。如同鹼金族的氟化物,氟化銀(I) 可溶解在氫氟酸中可形成導電性溶液。
應用:
氟化銀(I) 可應用在有機化學中氟的加成反應,例如在乙腈中將氟化銀與過氟烯 (perfluoroalkenes) 反應可得到過氟烷銀(I) (perfluoroalkylsilver (I)) 的衍生物。由於氟化銀(I) 在水中及有機溶劑中的高溶解度,它是反應中氟離子很好的來源,且能在溫和的條件下使鹵烷氟化。請參看下例:
在無機化學方面,可利用氟化銀 (I) 蒸氣在 $$60-800^\circ C$$ 在矽的表面塗佈銀,厚度約為 $$0.1$$~$$1~\mu m$$,反應如下:
$$\mathrm{4AgF+Si}{\longrightarrow}\mathrm{4Ag+SiF_4}$$
連結: 鹵化銀(二)
參考文獻
- Silver bromide — Wikipedia.(檢索日期2015/06/10)http://en.wikipedia.org/wiki/Silver_bromide
- Silver chloride — Wikipedia.(檢索日期2015/05/15)http://en.wikipedia.org/wiki/Silver_chloride
- Silver fluoride — Wikipedia.(檢索日期2015/05/12)https://en.wikipedia.org/wiki/Silver(I)_fluoride
- Silver halide — Wikipedia.(檢索日期2015/05/05)http://en.wikipedia.org/wiki/Silver_halide
- Silver Iodide — Wikipedia.(檢索日期2015/06/15)https://en.wikipedia.org/wiki/Silver_iodide
- Cotton, F. A., Wilkinson, G., Murillo, C. A., Bochmann, M., & Grimes, R. (1999). Advanced inorganic chemistry (Vol. 1355). New York: Wiley.
- Wurtzite crystal structure — Wikipedia. https://en.wikipedia.org/wiki/Wurtzite_crystal_structure



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  化學的填字遊戲?
化學的填字遊戲?  化學傳記:法拉第不為人知的一面(八):電解定律
化學傳記:法拉第不為人知的一面(八):電解定律  暖暖包的原理
暖暖包的原理 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名 
