解離(The Dissociation)
解離(The Dissociation)
台北縣立樹林高級中學化學科蔡孟璇實習老師 / 國立台灣大學化學系陳藹然博士責任編輯
化合物如鹽類等分解成較小的組成粒子、離子或自由基的過程稱為「解離(Dissociation)」,解離在化學或生物化學上是個常見且重要的行為。 如鹽酸在水中解離為氫離子和帶負電的氯離子。反之,其逆反應為離子或分子等組合成較大的分子,這個過程稱為「再結合或再化合(Recombination)」。對一個化合物AB,解離常數Kd為組成粒子A、B濃度的乘積除以AB的濃度(式一)。
以下就常見的幾種物質的解離平衡做介紹。
一、水
水由氫離子與氫氧根離子組成,兩個水分子會發生自解離行為(Self-ionazion,Autoprotolysis)產生一個水合氫離子(H3O+)與ㄧ個氫氧根離子。
由於水的濃度為常數,故Kd可改寫為 Kw 為式三:
Kw 稱為「離子積常數或自解離常數(Ion product constant 或 Self-ionization constant)」,在標準室溫室壓條件(SATP,1 atm / 298 K)下,Kw 為1.0 X 10-14。
二、 酸
酸(HA)在溶液中的解離表示釋放出氫離子(H+),同時氫離子也不斷和其共軛鹼(A–)再結合為酸。酸的解離常數稱為 Ka(Acid dissociation constant,酸鹼離常數), Ka可以用來判斷酸的強度,當Ka值越大時,表示酸的強度越大;但是要注意有所使用的溶劑,只有在不完全解離的狀況下,用Ka 來判斷酸的強度才有意義。
三、 鹽類
鹽類為離子化合物,在水中經由組成離子和水形成水合離子的形式解離;當溶劑(水)被蒸發後,解離的水合陽離子和陰離子因失去分離力量再結合得到鹽類。
電解質指的是含有可游離的離子且可以作為電的傳導媒介。以鹽類(MX)的解離為例,其解離常數Kd為
因為鹽類為固體,濃度不變,故Kd可改寫為 Ksp 為式五:
Ksp 稱為「溶解度積常數(Solubility product)」,用來判斷鹽類在溶劑中的溶解難易度,Ksp 越大的鹽類,其溶解度越好。如果是非一價離子的鹽類,式五修正為:
四、氣體
氣體的解離平衡以分壓表示,例如四氧化二氮的解離,其平衡式為 :
![]()
p 表示分壓。以![]() (Alfa)來表示氣體的解離百分比,假設N2O4的初始濃度為1,當解離
(Alfa)來表示氣體的解離百分比,假設N2O4的初始濃度為1,當解離![]() 時會生成2
時會生成2![]() 的NO2,Kp 和
的NO2,Kp 和 ![]() 之間所存在的關係
之間所存在的關係

pT表示總壓。根據勒沙特列原理(Le Chatelier’s Principle),Kp 為常數,若在系統中加壓,即增加 pT ,為了 Kp 保持不變,導致![]() 會降低,因此在平衡中增加壓力會使反應傾向左邊,也就是促進 N2O4 的生成。
會降低,因此在平衡中增加壓力會使反應傾向左邊,也就是促進 N2O4 的生成。
參考資料:
1. http://en.wikipedia.org/wiki/Dissociation_(chemistry)
2. http://en.wikipedia.org/wiki/Self-ionization_of_water


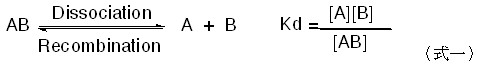

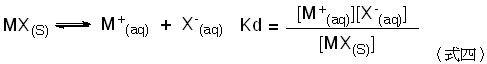
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性  化學的填字遊戲?
化學的填字遊戲?  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  強化玻璃
強化玻璃 

酸性物質溶於水解離出氫離子,但水溶液中氫離子與氫氧根離子同時存在,請問氫氧根離子是從何處解離出來的?是水嗎?
請問在Ksp計算時使用的是溶解度 但不是說溶解不一定解離嗎