氧化劑(Oxidizing Agent)
氧化劑(Oxidizing Agent)
國立林口高級中學化學科林明祥老師 / 國立台灣大學化學系陳藹然博士責任編輯
在氧化還原的反應中,如何判斷反應物何者為氧化劑,何者為還原劑是一件重要的事。本文主要針對氧化劑做介紹,關於還原劑本站有另一篇文章可參考。
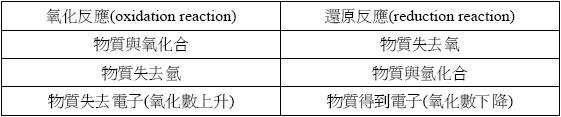
首先,我們需再複習一下關於氧化還原反應的三種概念,整理如下:
在氧化還原反應中,我們把發生還原反應的反應物定義成氧化劑。根據此定義,配合以上關於還原反應的概念,我們可以歸納出擔任氧化劑物質可能有以下特徵:
1. 本身失去氧
2. 本身得到氫
3. 本身得到電子(氧化數下降)
以氧化鐵與一氧化碳的反應來說明:
從反應式中我們可以得知反應物氧化鐵失去氧而形成了鐵,且鐵的氧化數由+3→0;反之一氧化碳則得到氧形成了二氧化碳,碳的氧化數由+2→+4;由此判斷此反應中氧化劑應為氧化鐵。
常用氧化劑及其還原後產物見下表:

從上表中我們可以發現兩個比較特別的例子。其一:過錳酸鉀(KMnO4)在不同pH環境下會有不同產物;此外,硝酸(HNO3)濃度不同,產物也會不同,這和氧化劑(還原劑)的還原電位有關係,而物質本性、壓力、溫度、濃度(pH)等都會影響還原電位,導致同一個氧化劑進行不同程度的還原,產生不同的還原產物。
參考資料:
1. 曾國輝,《化學(上冊)第二版》,藝軒圖書出版社,第626-640頁,2001年1月。
2. http://en.wikipedia.org/wiki/Oxidizing_agen


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法 
