陽極
陽極 (Anode)
國立臺灣大學化學系學士生張育唐/國立臺灣大學化學系陳藹然博士責任編輯
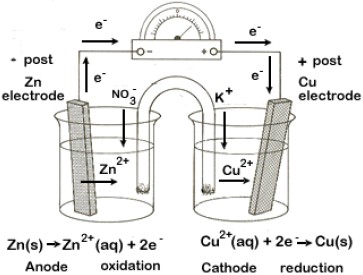
陽極 (Anode),是在一對電極當中發生氧化半反應的電極。與其相對的是陰極 (Cathode);在陰極則會發生還原半反應。在電化電池 (Electrochemical cell)中進行的電化學反應發生在電極與溶液的界面,反應的發生來自於電子的流動。
一般而言,電子流會由陽極流出,經過外電路而從陰極流入。在電解時,陽極的金屬會氧化,釋放出電子進入外電路,而同時金屬形成離子進入電解液。或者是針對電解液當中的成份進行氧化反應,例如電解水時,在陽極便會產生氧氣,反應式可以寫作下式:
2 H2O → 4 H+ + O2 + 4 e–
相對應的,電解水時陰極就會產生氫氣。然而在其他溶液的電解時,即便陽極產生氧氣,陰極也不一定會產生氫氣;而必須隨其材質而定,反之亦然。
工業上常用的電鍍 (Electroplating)反應,乃利用電解液中的金屬離子可還原成金屬於陰極,當陰極為待鍍物時,此金屬便可鍍於待鍍物表面。然而,在電鍍過程中溶液裡的金屬離子濃度會因還原消耗而不斷降低,因此,進行氧化反應的陽極可採用相同的金屬,如此一來在電鍍時,陽極金屬氧化所產生的金屬離子就可以補充陰極還原反應所降低的金屬離子濃度,達到溶液當中離子濃度的恆定。
將氧化電位較高的金屬陽極與欲保護的金屬互相連接,欲保護的金屬成為陰極,稱為陰極保蝕(Cathodic protection)。當欲保護的金屬接觸到腐蝕性的溶液,金屬陽極代替欲保護金屬被氧化,那麼其結構也就幾乎不會受損。一般而言陰極保蝕法應用於船舶的結構;其陽級金屬多選擇為鋅,因為鋅的氧化電位較高, 也比較便宜。而如白鐵(Galvanized iron)也是利用類似的原理,透過在鐵上鍍一層鋅來保護內部的鐵結構。
參考資料:
1. Zumdahl, S. S. Chemical Principles, 5th edition; Houghton Mifflin Company: Boston, 2003; p. 464.
2. Wikipedia– Anode http://en.wikipedia.org/wiki/Anode


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 強化玻璃
強化玻璃  化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性
化學傳記:法拉第不為人知的一面(十):法拉第效應與反磁性  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間 
