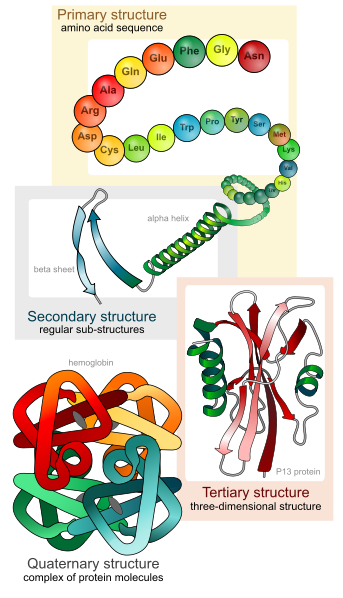
蛋白質立體結構(protein structure)的解析–上
蛋白質立體結構(protein structure)的解析–上
台北市立成功高級中學生物科洪敬承老師/國立台灣師範大學生命科學系李冠群助理教授責任編輯
分析蛋白質立體結構的程序大致如下,先以基因轉殖的大腸桿菌大量生產標的蛋白質,其方法為利用分子選殖技術將研究標的基因DNA,置入大腸桿菌的表現載體,之後利用轉型技術將表現載體轉入大腸桿菌中,表現的蛋白質其胺基酸序列可由DNA可以推導出,接下來進行一系列蛋白質的純化步驟,取得高純度的蛋白質後,運用化學試劑將水溶性的蛋白質,轉換成蛋白質晶體,在X光繞射法下,將所得數據經由一系列的數學運算,轉換得其三維立體結構。
為了得到菌體內未變性(即未喪失三級結構和活性)的蛋白質,將基因轉殖菌體加入機器中的容器內,再以高壓破菌器Fresh Press將容器內的基因轉殖菌體,快速通過容器的小孔出口(其口徑小於大腸桿菌),如此即可將具有細胞壁的大腸桿菌,壓破釋放出菌體內的各種蛋白。
利用快速液相色譜儀(FPLC)搭配不同性質和特性的純化蛋白質用的管柱,依照研究標的蛋白質的特性,可以從已破菌的菌液中分離出標的蛋白質。純化蛋白質用的管柱,可以分為:(1)親和性管柱:經典代表為鎳金屬的樹脂,當將研究標的在其蛋白質的頭或尾端,加上6個His(可與鑷金屬結合形成敖合物),之後在利用與His類似的化合物,與和鎳金屬結合的蛋白質競爭,進而分離出帶6個His的研究標的蛋白質;(2)分子篩管柱: 可以依照分子量大小不同,導致流出管柱的時間點不同來分離;(3)離子交換樹脂管柱:利用蛋白質在不同pH值下,會使蛋白質改變其本身的電荷,來達到吸附管柱的效果,將研究標的蛋白質與其他大腸桿菌本身所攜帶的蛋白質分離。
利用UV光OD280(波長280nm)可偵測蛋白質的特性,可以將從管柱流出的蛋白質繪出吸收峰圖型,在對照收集圓盤內所純化蛋白質的收集試管,搭配蛋白質電泳SDS-PAGE觀測,取試管內的液體進行蛋白質電泳,可以更加確定蛋白質的分子量及純度。
在確認試管內蛋白質為研究標的蛋白質後,接下來就是近一步確定研究標的蛋白質的純度是否達到水準,基本上須達到95%以上的純度,之後接著進行蛋白質濃縮的工作,因為需要將蛋白質濃縮到快接近過飽和的狀況,才有機會長出晶體,在蛋白質結晶方面,藉由配製出適合該種蛋白質的介質,使該蛋白質達到飽合濃度,進而析出長出晶體,這時需借助生技公司開法的片盤.,每個片盤上有96個孔洞,孔洞內則有不同條件的介質以利蛋白質的析出與長晶。通常需試上1000種以上的條件才可找出最接近一種蛋白質析出或長晶的介質,此過程稱為結晶條件之隨機篩檢(random scan)。接著以此種介質為條件,人工配置微調介質成份的自製介質,再將此一蛋白質放入新片盤,藉以得到一種蛋白質析出或沉澱的最佳濃度或成份比例,可將蛋白質置於光學顯微鏡下觀察其結晶形狀,確認最佳蛋白質析出或沉澱之介質。
參考文獻:
維基百科-蛋白質結構:http://en.wikipedia.org/wiki/Protein_structure


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2014諾貝爾生醫獎】發現大腦裡空間記憶的構築細胞
【2014諾貝爾生醫獎】發現大腦裡空間記憶的構築細胞 ![[新聞] 發現臺灣目前最古老人類化石](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/pe.png) [新聞] 發現臺灣目前最古老人類化石
[新聞] 發現臺灣目前最古老人類化石  悲傷與快樂的音樂引起不同的腦部活化型態
悲傷與快樂的音樂引起不同的腦部活化型態  細胞內測量長度的蛋白質
細胞內測量長度的蛋白質 ![[講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/09/Sonline.png) [講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章
[講座] [探索基礎科學系列講座16]命孕交響曲的四大樂章  【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)
【2015諾貝爾生醫獎特別報導】阿弗麥克素及青蒿素-對抗寄生蟲疾病的革命性治療法(三)  近視可能與基因有關
近視可能與基因有關  白蟻透過腸道微生物高效率獲得能量
白蟻透過腸道微生物高效率獲得能量 
