布-洛酸鹼學說
布-洛酸鹼學說 (The Brønsted-Lowry Acid Base Theory)
國立臺灣大學化學系林雅凡博士/國立臺灣大學化學系李俊毅責任編輯
西元1923年,丹麥化學家布忍斯特 (Johannes Nicolaus Brønsted, 1879-1947)與英國化學家洛瑞 (Thomas Martin Lowry, 1874-1936),不約而同對阿瑞尼士 (Svante August Arrhenius, 1859-1927)的酸鹼理論提出相近的修正,拓展人們對酸鹼化學的認知,不只侷限於水溶液的狀態,是為「布-洛酸鹼學說 (The Brønsted-Lowry Acid Base Theory)」。
言簡意賅地說,「布-洛酸鹼學說」將酸定義為「質子捐贈者 (proton donor)」;而鹼定義為「質子接受者 (proton acceptor)」。「給予質子」的能力越強者,是為較強的酸;「接受質子」的能力越強者,是為較強的鹼。在這樣的概念下,扮演「酸」角色的化學物質,可以是陽離子 (cation)、中性分子 (neutral molecule)、或陰離子 (anion);扮演「鹼」者,則可為中性分子或陰離子。
若進一步探究『布-洛酸鹼學說』之內涵,讀者或許值得審思以下兩個問題: 其一,如果酸是質子給予者,那麼其釋出的質子該往何處去?相對地,若鹼為質子接受者,此質子其來何自? 其二,一旦酸失去質子後,會變成什麼物質呢?鹼接受質子後,產物又是如何? 第一個問題的答案,其實顯而易見。依據「物質不滅定理(Law of Conservation of Mass)」,反應中若有一物質提供質子,那麼必定要有另一物質扮演接收者,以吸收被釋出的質子。這樣的事實說明了,在『布-洛酸鹼學說』所定義的酸或鹼,都不能各自唱獨角戲、單獨存在;反應中一定要存在「鹼性物質」的角色,酸性物質的角色才能進行,反之亦然。 以醋酸 (acetic acid, CH3COOH)水溶液作為例子說明,醋酸分子在水中之所以能扮演酸而釋出質子,乃因有「水分子」作為接受質子的鹼。若將反應以化學方程式表之,則如以下:
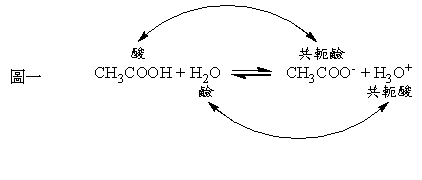
如圖一,醋酸與水的酸鹼反應中,醋酸釋出質子後,形成醋酸根離子 (acetate ion, CH3COO–);而水接收質子形成水合氫離子 (hydronium ion, H3O+)。從產物的觀點來看,水合氫離子在逆反應的途徑中,作為酸、釋出質子變為水;而醋酸根離子則恰如其分的扮演鹼的角色,接受酸所釋出的質子,形成醋酸。以上的例子,同時也提供第二個問題答案的線索。事實上,由布忍斯特建構的酸鹼理論,對此有精闢精確的說明。在他所發表的論文中,是這樣描述的: 「當酸釋出質子之後,本身理所當然形成鹼,是為酸的共軛鹼 (conjugate base);相對的,當鹼得到質子後,即形成其共軛酸。」若以醋酸水溶液的例子為說明,醋酸分子 (CH3COOH)在正反應中扮演酸,丟掉質子後,形成其共軛鹼-醋酸根離子 (CH3COO–);而水分子 (H2O)則扮演鹼,得到質子後,形成其共軛酸-水合氫離子 (H3O+)。為求一目瞭然,布忍斯特以簡單的化學方程式表達:
Acid1+ Base2 $$\rightleftharpoons$$ Acid2 + Base1 (式一)
其中,Acid1與Base1互為共軛酸鹼對; Acid2與Base2是另一對共軛酸鹼對。 針對「共軛酸鹼對」,布忍斯特也提出說明:如果反應中,物質為較強的酸,則其共軛鹼必為較弱的鹼,意思是,若一物質釋出質子的能力較強,則其共軛鹼吸收質子的能力必定較弱。
相反地,若物質本身為較弱的酸,則其共軛鹼必為較強的鹼;而鹼與其共軛酸之間的關係也相仿。舉個例子,鹽酸 (HCl)是眾所周知的強酸,極易釋出質子,相對地,其共軛鹼-氯離子 (Cl–)則是一個弱鹼,並不容易搶奪質子。再以這樣的觀點看布忍斯特所提出的化學方程式(式一),其實反應物 (Acid1, Base2)與產物 (Acid2, Base1)之間,是互為競爭的酸鹼反應,依此理論,我們可以預測,其自發 (Spontaneous)的反應方向,應由「較強酸-鹼」的一方,走向「較弱酸-鹼」的一方,也就是以Acid1與Acid2中較強者,及Base1與Base2中較強者為反應物 (reactants)之進行趨勢,因「較強酸-鹼」也代表「給-受質子」的能力較好。 再以醋酸水溶液的例子說明,如圖一,其 (Acid1, Acid2)為 (CH3COOH, H3O+),兩者釋出質子能力較優者為H3O+,是為較強酸;其 (Base1, Base2)為 (CH3COO–, H2O),兩者接受質子能力較好者為CH3COO–,是為較強鹼,故反應的趨勢應以「逆反應」方向為其喜好方向。
為文的最後,再提綱挈領,點明『布-洛酸鹼學說』的精髓:
(1) 布洛學說中,反應物中,必定有一物質扮演酸--做為質子捐贈者;另一物質扮演鹼--做為質子接受者。
(2) 布洛學說中,反應物與產物之間,必為兩對『共軛酸鹼對』,反應物作為酸者,產物形成共軛鹼;反應物作為鹼者,產物形成共軛酸。
(3) 在『共軛酸鹼對』中,若本身為較弱酸,則其共軛鹼為較強鹼;本身為較弱鹼,其共軛酸為較強酸。
(4) 布洛學說中,酸鹼反應的自發趨勢,傾向由強酸強鹼的一方,向弱酸弱鹼方向進行。
閱後小問答:
在布-洛酸鹼學說中,提到「酸鹼反應」在自發的情況,傾向由強酸強鹼,走向弱酸弱鹼的一方。那麼如果反應物與產物之間的酸鹼關係是(較強酸,較弱鹼)與(較弱鹼,較強酸),則反應應往那一個方向進行?為什麼?
解答:
這或許是許多人心中的疑問,但若仔細思考『布-洛酸鹼學說』所提出的概念,會發現這樣的情況並不會發生。在Acid1+ Base2 → Acid2 + Base1 中,(Acid1, Acid2)若為(較強酸, 較弱酸),則(Base1, Base2)必定為(較弱鹼, 較強鹼),因為Acid1與Base1互為『共軛酸鹼對』;Acid2與Base2互為『共軛酸鹼對』,如果酸的強度是Acid1>Acid2,則其共軛鹼的強度必定為Base1→2,如此一來,分析Acid1+ Base2 → Acid2 + Base1的反應,應為較強酸+ 較強鹼 → 較弱酸 + 較弱鹼,傾向正反應發生方向;同樣的道理,(Acid1, Acid2)若為(較弱酸, 較強酸),則Acid1 + Base2 → Acid2 + Base1,應為較弱酸+ 較弱鹼 → 較強酸 + 較強鹼,此時傾向逆反應方向。
參考資料
Kauffman, G..B. “The Brønsted-Lowry Acid-Base Concept”, J. Chem. Edu., 1988, 65, 28 – 31. 2. Brønsted, J. N. “Acid and Basic Catalysis”, Chem. Rev., 1928, 5, 231-338. 3. Brønsted, J. N. “The Acid-Basic Function of Molecules and Its Dependency on the Electric Charge Type”, J. Phys. Chem., 1926, 30, 777-790.


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破 
