探討溶液沸點上升、凝固點下降的原因
探討溶液沸點上升、凝固點下降的原因
國立臺灣師範大學化學系兼任教師邱智宏
純溶劑中若加入非揮發性的溶質,將使溶液的沸點上升,凝固點下降。雖然溫度的上升量或下降量,可以使用公式計算出來,但是其真正上升及下降的理由為何?卻值得深入探討。
由熱力學的基本公式可知純物質的化學能 $$(\mu^*)$$,可由下式表示:
$$d\mu^*=-S_mdT+V_mdp~~~~~~~~~(1)$$
其 $$S_m$$ 純物質的莫耳熵,$$V_m$$ 為莫耳體積。在固定壓力時,$$(1)$$ 式最後一項為 $$0$$,可改寫成
$$\displaystyle \frac{d\mu^*}{dT}=-S_m~~~~~~~~~(2)$$
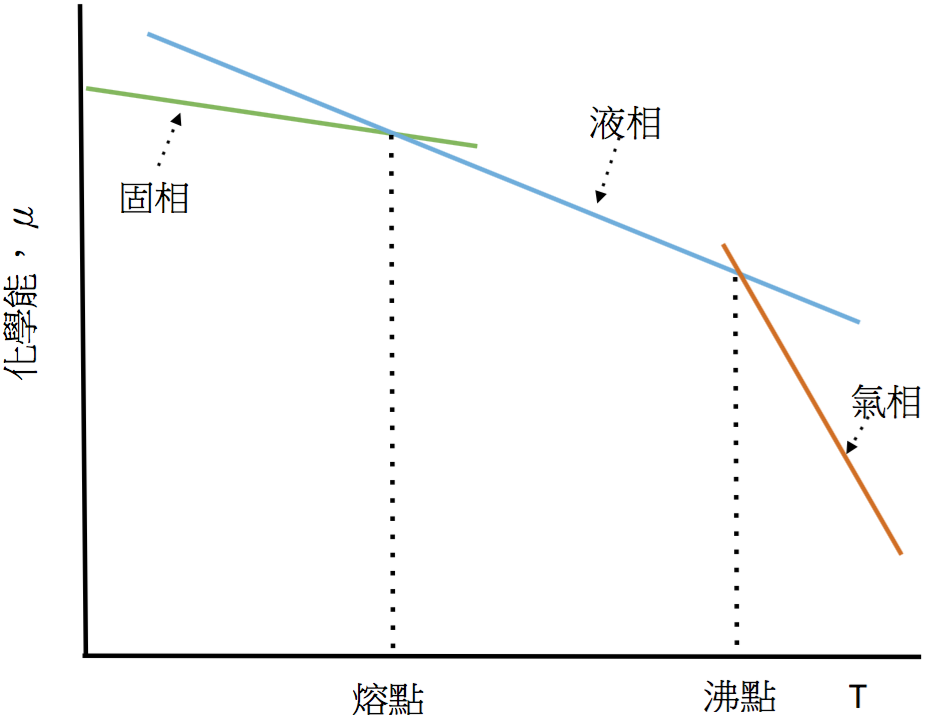
由式 $$(2)$$ 可以了解,純物質的化學能($$\mu^*$$),對溫度($$T$$)的變化率,等於 $$-S_m$$,為一負值。因為物質的熵恒為正值,故 $$-S_m<0$$,即以化學能對溫度作圖,可得一斜率為 $$-S_m$$ 的直線。通常同一物質的熵,氣體大於液體,固體最小,若以亂度來解釋,物質的分子在固體時排列較整齊,亂度最小,在氣體時分子四處流竄,亂度最大,所以 $$S_g>S_l>-S_s$$。若將純物質的化學能對溫度的變化作圖,可得圖一。
由圖中可看出,氣相的直線最陡,液相次之,固相最平緩。
當在低溫時,固相的化學能比液相及氣相為低,因此在低溫時,純物質以固相存存最安定。
若溫度繼續升高,會出現固相化學能和液相化學能相等的平衡點,即二線的交點,此時固、液兩相共存,此點的溫度稱為該物質在特定壓力下的熔點或凝固點。溫度高於熔點後,此時液相的化學能低於固相,因此在這段範圍內,該物質以液相存在最安定。
若溫度再繼續升高,則會出現液相化學能和氣相化學能相等的平衡點,即液相、氣相二線的交點,此時氣、液兩相共存,此點的溫度稱為該物質在特定壓力下的沸點。
溫度高於沸點後,此時液相的化學能高於氣相,所以在沸點以上的溫度,物質以氣相存在最安定。
當非揮發性溶質溶入純溶劑後,由於固相的溶質和固相的純溶劑並不會互溶,而且既然為非揮發性溶質,在氣相不存在溶質分子,對於氣相的溶劑也不會有影響,因此該溶液在固相、氣相的化學能和純溶劑時相等。但是溶液中溶劑的化學能就和純溶劑時不同。經由熱力學公式的推導可知,理想溶液的化學能($$\mu$$)和純溶劑的化學能($$\mu^*$$)之間存在下列關係:
$$\mu=\mu^*+RT\ln X~~~~~~~~~(3)$$
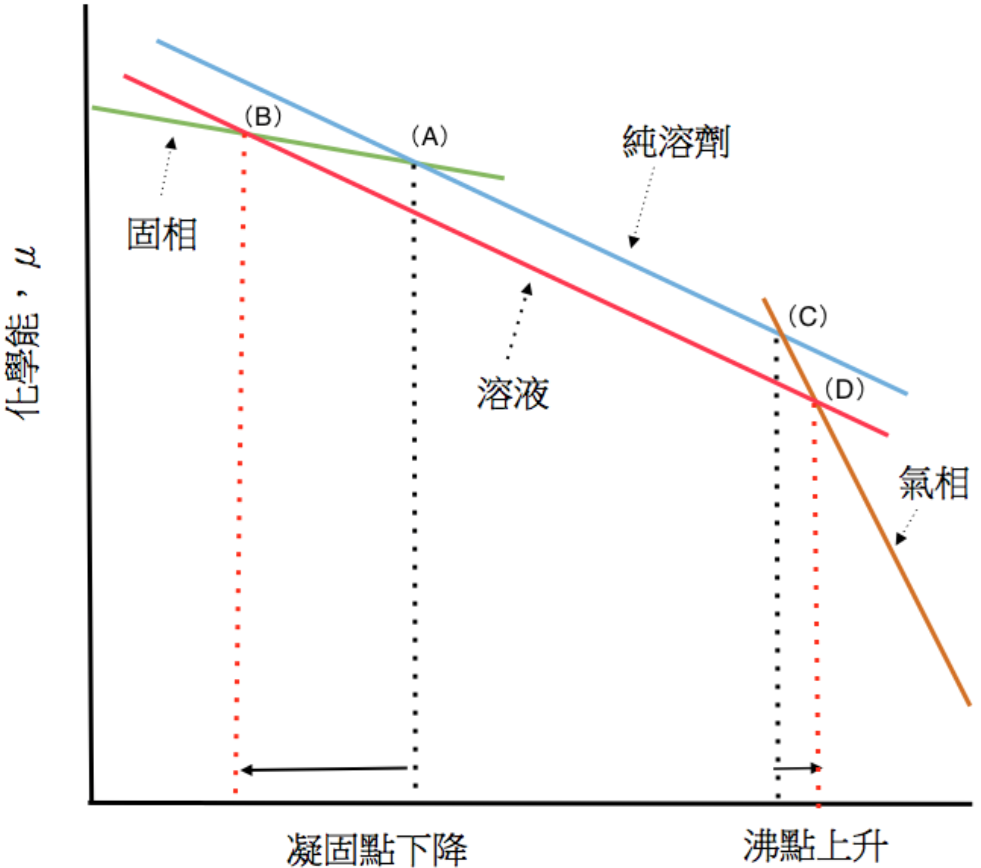
式 $$(3)$$ 中的 $$X$$ 代表溶劑的莫耳分率,其值小於 $$1$$,所以 $$\ln X<0$$。由式中可知在任一溫度下,$$\mu^*>\mu$$,若將溶液的化學能對溫度的變化情形畫在圖一中,則得圖形約略如圖二的線段。
由圖中可看出,氣相和液相的化學能在加溶質前後並没有改變,而溶液的化學能則比純溶劑下降。因此代表固相和溶液化學能的線段相交的點,由原先的 $$A$$ 點移至 $$B$$ 點,即其相對應的凝固點明顯的出現下降。線段的另一方向,溶液和氣相的交叉點為 $$(D)$$,代表其沸點由 $$(C)$$ 點對應的溫度上升至 $$(D)$$ 點對應的溫度。
經過上列化學能公式的引用及說明,雖然能了解含有非揮發性溶質的溶液,會使其沸點上升,而凝固點下降,但是真正隱含在化學能內的驅動力量究竟是什麼?仍然有些抽象,是熵(entropy)還是焓(enthalpy)?
理想溶液(ideal solution)的定義為:當兩純物質液體混合時,若各成分的蒸氣壓隨其莫耳分率的改變量合乎拉午耳定律者稱之,亦即溶劑分子間的作用力,和溶質分子間的作用相等,也和溶質分子及溶劑分子間的作用力相同。
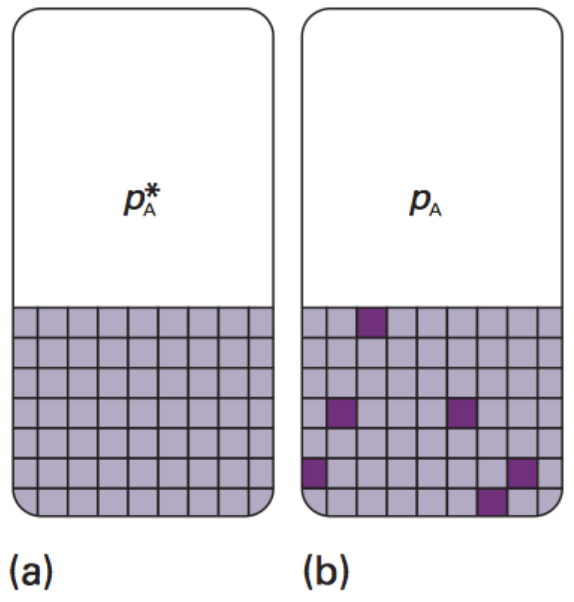
據此,溶質和溶劑混和時,並没有焓的變化,因此理想溶液的沸點會上升,凝固點會下降,顯然是來自熵的驅使。若使用亂度的觀點來看熵,如圖三所示,$$(a)$$ 圖為純溶劑,整齊的四方格子想像成溶劑分子,亂度小、熵較低。$$(b)$$ 圖為加入棕色方塊的溶質分子時,亂度增加。
在 $$(a)$$ 圖的純溶劑時,氣相的亂度大於液相,因此分子往亂度大的方向移動,亂度相差愈大,驅使力愈大。在 $$(b)$$ 圖中的狀況,液相中的亂度己經增大,因此和氣相間的亂度差變小,因此驅使溶劑分子到氣相的動力也減小,蒸氣壓因而下降,故其沸點必須上升,才能達到和純溶劑在原沸點時的蒸氣壓。凝固的情形也相同,由於溶液中的亂度比純溶劑大,不利於凝固成亂度更小的固相,因此必須降更低的溫度,固、液兩相的平衡方能達成,凝固點因而下降。
參考資料
- http://www2.chem.uic.edu/tak/chem34013/Chem%20340%20-%20Notes%209.pdf
- P. W. Atkins, “Physical Chemistry”, Oxford University Press, Oxford, 5th ed., p.223 (1994).


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚  化學傳記:法拉第不為人知的一面(十一):凡人法拉第
化學傳記:法拉第不為人知的一面(十一):凡人法拉第  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講 

請問 若是在純溶劑中加入揮發性溶質例如乙醇 凝固點是否會受到影響? 為什麼?