光氣(phosgene)
光氣(phosgene)
國立臺灣師範大學化學系黃鈺雅碩士班二年級
越南戰爭期間(西元1955年~1975年),美軍曾使用落葉劑,使越軍無法躲藏於樹林中,此案例係過去較為人熟知,因使用化學武器之因素,得以以寡敵眾之戰爭。
其實化學武器早在第一次世界大戰時已被廣泛應用,而法國為此戰役中率先使用催淚瓦斯之國家。接著德國亦在第二次伊普爾之役(Second Battle of Ypres)利用氯氣攻擊法國,使得德國得以運用較少之兵力,進而造成敵軍大量死亡或受傷,這是第一次這麼大規模地使用化學武器之戰役。隨後各國就蓬勃地展開研發新型的毒氣,其中常使用之氣體以芥子氣、氯氣與光氣為主,而本篇文章主要針對光氣之合成方式與其實際應用進行初步介紹。[1]
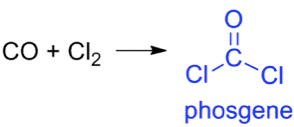
碳醯氯(俗名為光氣),其化學式為 $$\mathrm{COCl_2}$$,最早於西元 1812 年,由英國化學家約翰戴維(John Davy)所合成出,約翰戴維係藉以一氧化碳和氯氣混合後,照光下所產生。由於此氣體係藉光促進而生成,故一般俗稱為光氣(phosgene)。如圖1所示。
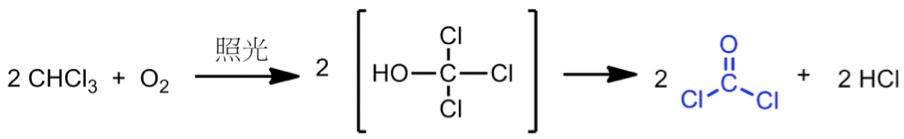
除了藉由上述方式製備得光氣外,亦可藉氯仿製備得來。氯仿 $$(\mathrm{CHCl_3})$$ 與氧氣在照光後先進行氧化反應,再行分解,即可獲得光氣(如式 $$1$$);此外,亦可利用四氯化碳 $$(\mathrm{CCl_4})$$ 與硫酸酐 $$(\mathrm{SO_3})$$ 進行反應而得到(如式 $$2$$)。[2]
於常溫下,光氣為無色且具有些許刺激腐臭草味的氣體。若人體長時間暴露於光氣環境下,恐造成刺激性與腐蝕性之傷害。而光氣之水溶性較低,當光氣經人體呼吸作用,吸入進體內後,恐導致遲發型肺水腫、急性呼吸窘迫綜合症等症狀,嚴重者恐因吸入大量光氣,而死於呼吸衰竭。[3]
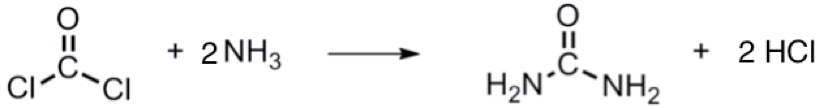
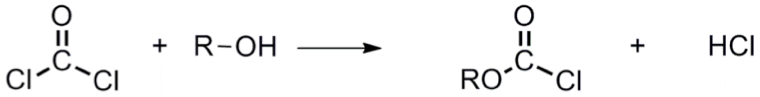
光氣常於有機合成上,進行許多衍伸及應用,例如:光氣與胺反應得以生成尿素(如式 $$3$$),另外光氣與醇作用則可生成酯類(如式 $$4$$)。於日常生活中,光氣亦常用以製造染料、聚碳酸酯塑料、製藥及農藥等…。
氣態的光氣難以貯存與量秤,因此在實驗室中,普遍會以雙光氣(diphosgene,$$\mathrm{C_2Cl_4O_2}$$) 和三光氣(BTC,$$\mathrm{C_3Cl_6O_3}$$) 作為光氣之替代品。[4][5]雙光氣為液態狀之光氣,易於取用,在進行催化或加熱下皆可發生分解,生成光氣。
三光氣則為固態狀之無色晶體,與光氣氣味類似,故又稱為固體光氣。於加熱狀態下,三光氣則可分解成光氣及雙光氣。另外,三光氣在含有氯離子的情況下,得以安全且定量地產生光氣,以解決光氣在反應中無法定量的問題。藉由雙光氣與三光氣此二類之替代光氣,使得光氣得以在實驗操作過程中,獲得更廣泛地運用。
參考資料:
- [1] 光氣在第一、第二次世界大戰時被用來當化學武器
http://zh.wikipedia.org/wiki/%E5%8C%96%E5%AD%A6%E6%AD%A6%E5%99%A8 - [2] 製備光氣的方法
(a) L. G. Wade, Organic Chemistry, 6th ed., p. 215, Prentice Hall, Upper Saddle River, New Jersey, 2006
(b) http://en.wikipedia.org/wiki/Phosgene - [3] 光氣對人體的危害
http://www.shs.edu.tw/works/essay/2005/10/2005103119063681.pdf - [4] 雙光氣
http://en.wikipedia.org/wiki/Diphosgene - [5] 三光氣
http://en.wikipedia.org/wiki/Triphosgene



 前一篇文章
前一篇文章 下一篇文章
下一篇文章![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  暖暖包的原理
暖暖包的原理  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體  中間體與穩定狀態近似法
中間體與穩定狀態近似法 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚 
