苯環的親電子取代反應
苯環的親電子取代反應 (Electrophilic Aromatic Substitution)
國立臺灣師範大學化學系三年級學生趙崇瀚
苯是一種不溶於水的揮發性液體,且其沸點及熔點較同碳數的烴類來得高,在醫藥、染料及有機合成方面都有廣泛的應用。
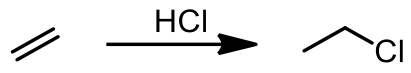
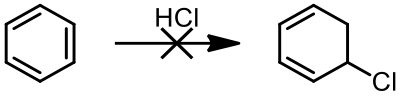
從苯主要的共振式中可以得知其具有部分雙鍵的性質,但是苯卻不像其他具有雙鍵的有機化合物一般,容易進行各種的加成反應,原因在於苯是符合休克爾規則 (Hückel’s rule) 的芳香族分子,一旦要進行加成反應,必須先破壞其原有的芳香性,所以反應的活化能相當大,通常需要在紫外線照射或是其他高能量的環境條件下才有可能進行。
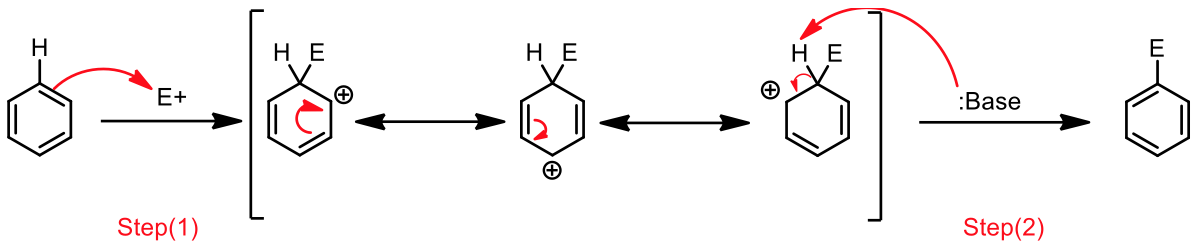
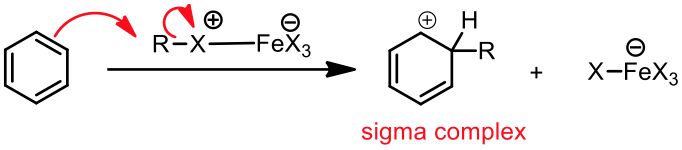
然而,只要在適當的催化條件下,苯卻很容易進行親電子取代反應,主要的反應機構為:$$(1)$$ 苯環作為親核劑,以其 $$\pi$$ 電子攻擊親電子劑 $$\mathrm{(E^+)}$$,形成一帶有部分正電的中間體 (sigma complex) 。此時苯環本身的芳香性會被破壞,所以需要有催化劑的輔佐。$$(2)$$ 鹼拔去中間體上的後,使芳香性回復,重新形成苯環。
所有的苯環親電子取代反應都會遵守這樣的規則,而在此基本的反應機構之下,苯環能夠與許多親電子試劑進行取代反應,最常見的反應類型為: (1) 與鹵素分子進行鹵化反應 (2) 與濃硫酸進行磺化反應 (3) 與硝酸在硫酸催化下的硝化反應 (4) 在路易士酸催化下與鹵烷進行的烷化反應 (Fridel-Crafts alkylation) 。而在接下來的討論中,我們會逐一介紹,並說明每種反應中的親電子劑及鹼。
$$(1)$$ 鹵化反應
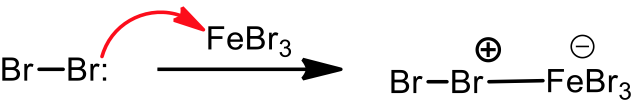
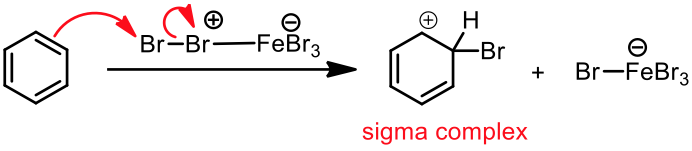
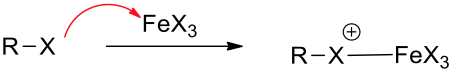
苯環在路易士酸的催化下,能夠與鹵素反應。以三溴化鐵催化苯環溴化為例,溴會先和三溴化鐵反應,生成 $$\mathrm{Br^{\oplus}-{FeBr_4}^{\ominus}}$$ 的錯合物,此錯合物即是反應中的親電子劑。
苯環上的 $$\pi$$ 電子攻擊錯合物的 $$\mathrm{Br}$$ 端,產生中間體 (sigma complex) 以及 $$\mathrm{{FeBr_4}^-}$$。而 $$\mathrm{{FeBr_4}^-}$$ 即是此反應中的鹼,它會再拔去中間體上的 $$\mathrm{H}$$,產生 $$\mathrm{HBr}$$ 及原有的路易士酸催化劑 $$\mathrm{(FeBr_3)}$$ ,並使分子恢復原有的芳香性,
除了三溴化鐵以外,三溴化鋁 $$\mathrm{(AlCl_3)}$$ 也常作為催化用的路易士酸。
在苯環的烷化反應中,除了溴化以外,氯化反應也是相當常見,與溴化反應唯一的差別在於路易士酸的選擇通常是用三氯化鐵或是三氯化鋁。然而,氟化反應與碘化反應較不常見。氟化反應過於激烈,不易控制。碘化的反應性不高,通常反應速率較慢,也沒辦法得到良好的產率。
$$(2)$$ 磺化反應
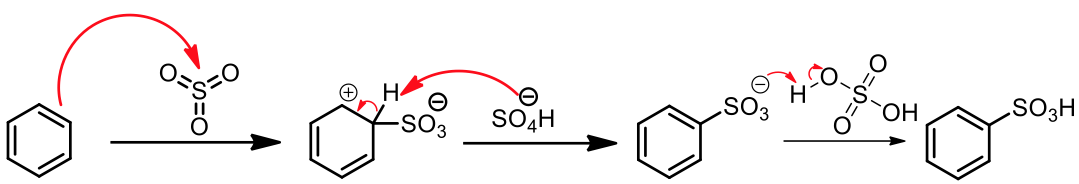
苯能夠與濃硫酸進行磺化反應,以 $$\mathrm{-SO_3H}$$ 基團取代碳上的 $$\mathrm{H}$$。濃硫酸可被視為 $$\mathrm{H_2SO_4}$$ 與 $$\mathrm{SO_3}$$ 氣體的混合。$$\mathrm{SO_3}$$ 即是反應中的親電子劑,又 $$\mathrm{H_2SO_4}$$ 是極強的酸,幾乎是完全解離,所以在反應環境中會產生 $$\mathrm{{HSO_4}^-}$$,其扮演鹼的角色,在最後拔除中間體的鹼,以恢復分子的芳香性。所以硫酸在此反應中可視為既是反應物,同時也是催化劑。
$$(3)$$ 硝化反應
在硫酸的催化下,苯能夠與硝酸反應,以 $$\mathrm{-NO_2}$$ 基團取代碳上的 $$\mathrm{H}$$。在布羅酸鹼學說中可知道,酸鹼性是相對的,相對於硝酸而言,硫酸是較強的酸。
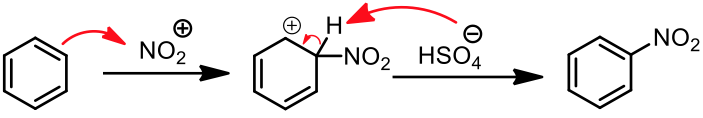
因此硝酸能夠被硫酸酸化,形成![]() 。此中間體脫水後會形成 $$\mathrm{NO_2^\oplus}$$,即是此反應中的親電子劑。同樣地,在反應環境中的 $$\mathrm{{HSO_4}^-}$$ 會以鹼的角色,在反應的最後拔除環上的 $$\mathrm{H}$$,恢復分子的芳香性。
。此中間體脫水後會形成 $$\mathrm{NO_2^\oplus}$$,即是此反應中的親電子劑。同樣地,在反應環境中的 $$\mathrm{{HSO_4}^-}$$ 會以鹼的角色,在反應的最後拔除環上的 $$\mathrm{H}$$,恢復分子的芳香性。
$$(4)$$ 烷化反應 (Fridel-Crafts alkylation)
苯有不同的烷化反應機制,但最常見的烷化機構為 Fridel-Crafts alkylation,通常用於合成較穩定碳鏈 (碳的級數高) 取代 $$\mathrm{H}$$ 的產物。Fridel-Crafts alkylation 與前述的鹵化反應有些類似處,通常反應中會用到含有欲接上苯環的碳鏈鹵烷及與該鹵烷含有同樣鹵素的路易士酸。
在此反應中,以路易士酸做為催化劑。鹵烷首先與路易士酸作用,形成與鹵化反應中類似的錯合物,此時鹵烷上接有鹵素原子的碳會產生部分的正電,碳鏈就成了反應中的親電子劑。($$\mathrm X$$:鹵素)
苯環上的 $$\pi$$ 電子攻擊帶部分正電的碳後,會產生中間體及脫去碳鏈後的錯合物。與鹵化反應類似的是,脫去碳鏈的錯合物會作為鹼,拔除環上的 $$\mathrm{H}$$,恢復分子的方向性,並重新獲得原本的路易士酸。 ($$\mathrm R$$:烷基)
苯環的親電子取代反應相當的多變,而且若使用含有不同取代基的苯環,進行親電子取代反應後,新接上的取代基位置會受原本就在苯環上的取代基所影響。這些相關的機制在有機合成中佔有相當重要的地位,因為可以利用不同取代基的特性,更改先後接上苯環的順序,可以合成出許多不同的有機化合物,而在此只做一些較基本的親電子取代反應的介紹。
參考資料
- David R. Klein (2012). Organic Chemistry (1st). John Wiley & Sons, Inc
- Wade, L. G. (2013) Organic chemistry / L.G. Wade, Jr. Boston : Pearson
- Vollhardt, K. Peter C. (2009) Organic chemistry : structure and function / K. Peter C. Vollhardt, Neil E. Schore. (6th ed.). New York: W. H. Freeman and Company


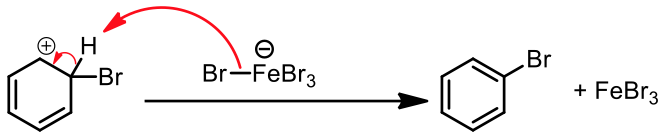
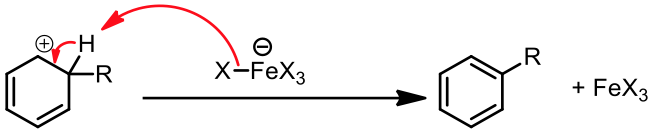
 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(十一):凡人法拉第
化學傳記:法拉第不為人知的一面(十一):凡人法拉第  【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器 ![[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/221.jpg) [新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應
[新聞] 臺灣年輕團隊成功捕捉「克里奇中間體」與水分子的關鍵化學反應  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法 
