紫外–可見光光譜學
紫外–可見光光譜學 (ultraviolet–visible spectroscopy)
國立臺灣師範大學化學系碩士生洪嘉駿
有許多化合物會吸收紫外光或者是可見光,特別是擁有 $$\pi$$ 電子和非鍵結電子($$n$$ 電子)的化合物會吸收紫外光而激發電子躍遷到更高能階的化合物,我們利用此現象來發展成定性分析的技術之一。紫外-可見光光譜除了可以用來做為定性分析之外,還可以把朗伯-比爾定律(Lambert-Beer’s law)應用其中而用於定量分析。
紫外光或可見光的吸收與分子的電子的激發有關;當特定能階的電子吸收了特定波長後會從原先的能階被激發而躍遷到其他的能階,再經由振動或轉動放出輻射(能量)躍遷回較低的能階。我們考慮下列幾種電子轉移情形:
- $$\pi$$、$$\sigma$$ 和 $$n$$ 電子的轉移。
- 電荷轉移(charge transfer)。
- $$d$$ 軌域和 $$f$$ 軌域電子的轉移。
$$\pi$$、$$\sigma$$ 和 $$n$$ 電子的可能轉移方式
電子在基態吸收了特定波長的輻射之後獲得能量,此電子的狀態便從會基態躍遷到其他能階成激發態。某些波長的光被吸收而其他波長的光被反彈之後此分子便會呈色。
$$\sigma\rightarrow\sigma^*$$
$$\sigma$$ 鍵的電子從最高佔用分子軌域(Highest Occupied Molecular Orbital, HOMO)被激發到最低未佔用分子軌域(lowest unoccupied molecular orbital)被視為 $$\sigma\rightarrow\sigma^*$$電子轉移。鍵結的 $$\sigma$$ 電子要躍遷到反鍵結軌域(antibonding)$$\sigma^*$$ 需要吸收很大的能量,例如甲烷的碳氫鍵只能有$$\sigma\rightarrow\sigma^*$$ 躍遷,最大波長只到125奈米的範圍(輻射的波長越短其能量越大),所以無法在紫外–可見光光譜中被偵測(紫外–可見光光譜應用譜帶範圍在波長約200-700奈米)。
$$n \rightarrow\sigma^*$$
擁有非鍵結孤電子對的飽和烴可以被150-250奈米的光激發行 $$n \rightarrow\sigma^*$$ 電子躍遷,此種電子躍遷的能量通常小於 $$\sigma \rightarrow\sigma^*$$ 的方式,且能有此種電子躍遷的化合物在紫外光區較少。
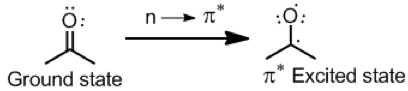
$$n \rightarrow\pi^*$$ 和 $$\pi \rightarrow\pi^*$$
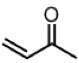
大部分有機吸收光譜是在 $$n$$ 或 $$\pi$$ 電子躍遷到 $$\pi^*$$ 的化合物,這兩種的吸收峰都在紫外–可見光區。例如擁有碳氧雙鍵的分子可以在紫外光區有吸收,$$n$$ 電子(非鍵結的電子)被激發到碳氧雙鍵的 $$\pi^*$$ 軌域,電子會有下列轉移情形,以丙酮為例:
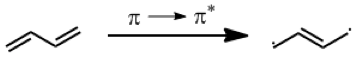
$$\pi\rightarrow\pi^*$$ 以 $$1,3-$$丁二烯為例
同時擁有碳氧雙鍵及碳碳雙鍵的分子則可以同時擁有 $$n\rightarrow \pi^*$$ 和 $$\pi\rightarrow \pi^*$$ 的吸收:
要注意的是不飽合烴(擁有雙鍵或參鍵)才可提供 $$\pi$$ 電子。
溶劑在紫外–可見光光譜中會影響化合物的吸收峰(peak),因此溶劑的選擇也是非常重要的一項注意事項。溶劑極性越大者會使得 $$n \rightarrow\pi^*$$ 的吸收峰往短波長端位移,此種往短波長端的位移稱作「藍位移」(blue shift),反之稱為「紅位移」(red shift),原因是因為有極性的溶劑在孤電子在溶劑化的時候降低 $$n$$ 電子軌域的能量。
至於 $$\pi\rightarrow\pi^*$$ 通常在極性溶劑中會有紅位移,起因於溶劑的極性會使得激發態和非激發態的能階能量都下降,只是對於激發態能階作用比較強而導致有些許的紅位移(激發態能階稍稍得靠近了非激發態能階而縮小了從非激發態要遷至激發態所需的能量),此狀況在 $$n\rightarrow\pi^*$$ 也會存在,只是影響太小而被藍位移的現象遮蔽了。
電荷轉移
許多無機化合物會有電荷轉移吸收,此無機物其中的一個基團需有電子供予(electron donating)的性質且有另一個扮演電子接受者(electron acceptor)的基團。
$$d$$ 軌域和 $$f$$ 軌域電子的轉移
通常,前兩週期之過渡金屬(transition metal)的離子和錯合物在至少一種的氧化態會吸收某一頻段的可見光而成色。填滿的和非填滿的 $$d$$ 軌域能量中的吸收與配體(ligand)和金屬的鍵結有關,這些d軌域的能量差異取決於金屬元素在週期表中的位置、氧化態和與它鍵結的配體的性質。鑭系金屬和錒系金屬中與吸收有關的電子($$4f$$ 和 $$5f$$)被較外層的電子遮蔽著,因此吸收峰通常會比較尖銳且不受只和外層電子鍵結的配體影響。
紫外–可見光光譜儀可見於被使用在高效液相層析儀(high-performance liquid chromatography, HPLC)來作於偵測器分析所分離出來的物質。
參考資料
- Douglas A. Skook, Donald M. West, F. James Holler and Stanley R. Crouch, Fundamentals of Analytic Chemistry, 8th edition, page 786-787.



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  化學傳記:法拉第不為人知的一面(四):化學家法拉第
化學傳記:法拉第不為人知的一面(四):化學家法拉第 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》 ![[講義] 科學史沙龍:陳竹亭教授、楊信男教授](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/01/科學史.png) [講義] 科學史沙龍:陳竹亭教授、楊信男教授
[講義] 科學史沙龍:陳竹亭教授、楊信男教授  棉籽粕中殘留的棉籽酚
棉籽粕中殘留的棉籽酚 
