標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (二)
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (二)
The enthalpy difference between the ideal gas and real gas under standard condition – a case study in C2H6 (II)
國立臺灣師範大學化學系兼任教師 邱智宏
連結:標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
二、伯特洛方程式和臨界點
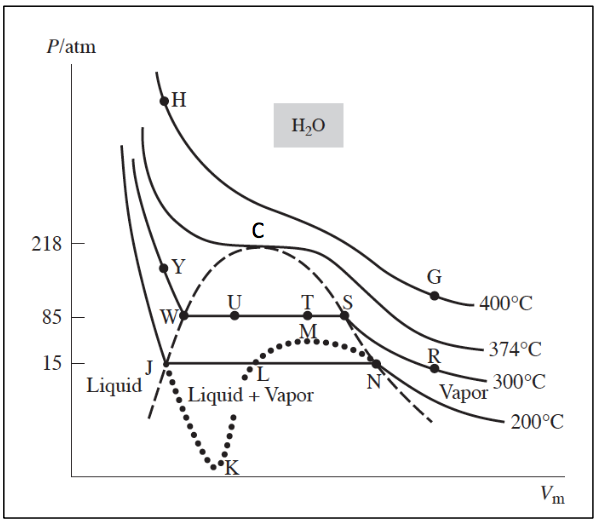
欲求出不同氣態物質在伯特洛方程式中的 $$a$$、$$b$$ 數值,則需對此方程式稍作瞭解。現以水蒸氣為例,以壓力對莫耳體積作圖,在 $$200^\circ C$$ 時,會出現一段水平線(NLJ),即體積減小壓力不變,此時開始有氣體凝結為液體,當溫度愈高時,水平的部分逐漸減短,到 $$374^\circ C$$ 時,水平線成為一點$$(C)$$,此點稱為臨界點( critical point ),此時液、氣間的界面消失,此點的溫度及壓力分別為臨界溫度$$(T_c)$$及臨界壓力$$(p_c)$$。
在臨界點時,$$\displaystyle (\frac{\partial p}{\partial V_m})_T=0,(\frac{\partial^2 p}{\partial V^2_m})_T=0$$ ,因此利用此特性,可求出該物質之伯特洛方程式在臨界點時,$$a$$、$$b$$ 值和 $$T_c$$、$$p_c$$ 間的關係。因此將伯特洛方程式即 $$(2)$$ 式對莫耳體積微分
$$\displaystyle (\frac{\partial p}{\partial V_m})_T=\frac{-RT}{(V_m-b)^2}+\frac{2a}{TV^3_m},~(\frac{\partial^2 p}{\partial V^2_m})_T=\frac{2RT}{(V_m-b)^3}-\frac{6a}{TV^4_m}$$
上列二式在臨界點 $$(T=T_c,p=p_c)$$ 時均等於 $$0$$,所以可簡化如下:
$$\displaystyle \frac{RT_c}{(V_{m,c}-b)^2}=\frac{2a}{T_cV^3_{m,c}},~\frac{2RT_c}{(V_{m,c}-b)^3}=\frac{6a}{T_cV^4_{m,c}}$$
將上列二式相除可得 $$V_m=3b$$,再將其代回 $$(2)$$ 式及上式,經過適當簡化,可得 $$a$$、$$b$$ 與 $$T_c$$、$$p_c$$ 間的關係如下:
$$\displaystyle a=\frac{27R^2T_c^3}{64p_c},~b=\frac{RT_c}{8p_c}$$
將上式代入 $$(11)$$ 式可得下式:
$$\displaystyle H^\circ_{m,id}-H^\circ_{m,re}\approx (\frac{3a}{RT^2}-b)p^0=(\frac{81RT_c^3}{64T^2p_c}-\frac{RT_c}{8p_c})p^0~~~~~~~~~(12)$$
三、$$\mathrm{C_2H_6}$$ 於 $$298.15~K$$ 的 $$H^\circ_{m,id}-H^\circ_{m,re}$$
經過冗長的推導,終於得到立即可用的 $$(12)$$ 式,只要將欲求物質的臨界溫度、臨界壓力及標準壓力,溫度代入,便可求出理想氣體與真實氣體間的焓值差,還好各物質的臨界壓力及溫度均為可查的實驗數據。經查 $$\mathrm{C_2H_6}$$ 的 $$T_c=305.4~K$$、$$p_c=48.2~atm$$,欲求 $$1~bar$$、$$298.15~K$$ 時的差異情況,可代入 $$(11)$$ 式,其計算結果所下:
$$\begin{array}{ll} H^\circ_{m,id}-H^\circ_{m,re} &\approx\displaystyle(\frac{81RT_c^3}{64T^2p_c}-\frac{RT_c}{8p_c})p^0\\&=\displaystyle(\frac{81\times 8.314\times 305.4^3}{64\times 298.15^2\times 48.2\times 101325}-\frac{8.314\times 305.4}{8\times 48.2\times 101325})\times 100000\\&=\displaystyle 62.54~J\cdot mol^{-1}\end{array}$$
由上式算出 $$H^\circ_{m,id}-H^\circ_{m,re}$$ 的值約為 $$62.54~J\cdot mol^{-1}$$,和實際的實驗值 $$62.70~J\cdot mol^{-1}$$ 比較,其相對誤差不到千分之 $$3$$。實際查表 $$\mathrm{C_2H_6}$$ 的莫耳生成焓為 $$-84.68~kJ\cdot mol^{-1}$$,雖然理想氣體與真實氣體間的焓值差佔整體莫耳生成焓的比例很小,但理論上仍是不可以省略的部分。
四、結論
本文以 $$\mathrm{C_2H_6}$$ 為實例計算在標準狀態為 $$1~bar$$、$$298.15~K$$ 時,其理想氣體與真實氣體間的相對焓相差多少。由計算結果顯示,兩者之間實際相差不大,僅佔整體莫耳生成焓的千分之一,但在理論上,仍舊是不可以忽略的部分。本文所利用模擬真實氣體的方程式,是使用伯特洛方程式,由於在低溫的情況,它的準確度比凡得瓦爾方程式來得準確,至於高溫的情況則恰好相反。整個公式的推導過程,除了伯特洛方程式以外,為了微分的便利性,尚使用了維里方程式及泰勒展開式等,足見數學的推導在物化課程中所扮演的重要角色。
另外,要求得純物質的莫耳生成焓$$(\Delta_f H^\circ_m)$$,事實上要經過下列6個步驟,現以 $$\mathrm{C_2H_6}$$ 為例說明如下:
- 生成 $$\mathrm{C_2H_6}$$ 的成份元素,在 $$1~bar$$、$$298.15~K$$ 時,石墨為固體,$$\mathrm{H_2}$$ 為氣體,兩者的相對焓雖均為零,但此時的 $$\mathrm{H_2}$$ 視為理想氣體,實際上在卡計中反應的 $$\mathrm{H_2}$$ 卻是真實氣體,因此需將其轉為真實氣體時的相對焓:算出 $$\Delta H_1$$。
- 計算所有成份元素在 $$1~bar$$、$$15~K$$ 時混合時焓的變化量:$$\Delta H_2$$,在此例中僅有一種氣體,没有混合的問題,其值為 $$0$$。
- 將混合物從 $$1~bar$$、$$298.15~K$$,提升至其在卡計內能完全反應的溫度及壓力,
此時焓的變化量:$$\Delta H_3$$,可經由右式算出:$$\Delta H_3=\int_{298}^T C_p\mathrm{d}T+\int_{p^0}^p(V-TV\alpha)\mathrm{d}p$$。
左式等號右邊的第一項為溫度由參考狀態的溫度 $$25^\circ C$$ 變成 $$T$$ 時所造成的焓變化,第二項則為壓力由標準壓力$$(p^0)$$改變成 $$p$$ 時焓的變化量,由於反應物已非理想氣體,真實氣體焓的變化不再只是溫度的函數,壓力也會影響。其中 $$\alpha=\frac{1}{V_m}(\frac{\partial V_m}{\partial T})_p$$,此式必需有真實氣體中 $$V_m$$ 和 $$T$$ 的關係,才有辦法微分,簡化的方法可以使用凡得瓦爾方程式(van der Waals equation)模擬真實氣體。 - 利用卡計測量反應完全轉變為產物時焓的變化量:$$\Delta H_4$$。
- 將反應後產物的溫度及壓力,再調回標準狀態,利用步驟3相同的方式,可以求出 $$\Delta H_5$$。
- 反應後的產物:$$\mathrm{C_2H_6}$$,為真實氣體,因此必須再調回規定的理想氣體狀態,其間焓的變化量即為 $$\Delta H_6=H^\circ_{m,id}-H^\circ_{m,re}$$。
上列6個步驟中,其中 $$\Delta H_4$$ 為最主要的貢獻者,但是精密的計算時,其他步驟亦不可省略,所以 $$\Delta_f H^\circ_m=\Delta H_1+\Delta H_2+\Delta H_3+\Delta H_4+\Delta H_5+\Delta H_6$$。本文所介紹的部分僅為上列步驟中的第6個步驟,至於其他部分,學子若有興趣,可自行參考物化的教科書籍或閱讀高瞻計畫資源平台的相關文章。
參考文獻
- N. Levine(1988), Physical Chemistry (3rd ed.). p211~225, McGRAW-HILL Book Company.
- 標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例,高瞻計畫資源平台,http://highscope.ch.ntu.edu.tw/wordpress/?s=邱智宏


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們
化學傳記:法拉第不為人知的一面(七):影響法拉第的宗教與人們  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  強化玻璃
強化玻璃 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  【2011諾貝爾化學獎】具有黃金比例的晶體
【2011諾貝爾化學獎】具有黃金比例的晶體 
