標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (一)
The enthalpy difference between the ideal gas and real gas under standard condition – a case study in C2H6 (I)
國立臺灣師範大學化學系兼任教師 邱智宏
熱力學的主要內容除了三大定律及相關公式外,最常被討論到就是一些狀態函數(state function),而其中經常被使用到的數值,就是純物質的焓(enthalpy)、自由能(Gibbs free energy)及熵(entropy),因此一般化學教科書均會將一些常見物質的相關數據,表列在附錄中,以供參考及使用。
但是這些數據是如何求得的?卻鮮少被討論,尤其表列純物質的焓,若在標準狀態下為氣體,則將該氣體設定為理想氣體。事實上理想氣體的標準莫耳焓\((H^\circ_{m,id})\)和真實氣體的標準莫耳焓\((H^\circ_{m,re})\)是不一樣的,它們之間的差距是多少?本文擬以 \(\mathrm{C_2H_6}\) 為例,利用熱力學的公式,按部就班的推導它們之間的差異,除了讓學子利用所學,真正應用在解決問題上,也期盼學子能感受到在計算過程中數學所扮演的重要角色。
一、標準狀態和公式推導
一般列表的熱力學數據,均有其訂定的標準狀態(standard state),通常為 \(1~bar\) 下的某特定溫度,此溫度若為 \(298.15~K\),則以 \(H^\circ_{m,298.15}\) 表示在 \(298.15~K\) 的標準莫耳相對焓(standard state molar conventional enthalpy),其中上標 \(\circ\) 表示標準壓力為 \(1~bar\),下標的 \(m\) 表示單位莫耳,另外,氣態純物質的標準狀態是假設其為理想氣體,而非真實氣體。
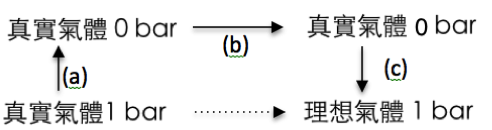
既然表列的標準狀態為 \(1~bar\)、\(298.15~K\),此時 \(\mathrm{C_2H_6}\) 被視為理想氣體,其標準莫耳生成焓為 \((\Delta_f H^\circ_m)\) 為 \(-84.68~J\cdot mol^{-1}\),若其為真實氣體則兩者之間會相差多少呢?由於焓是狀態函數,因此定溫下,要計算由 \(1~bar\) 真實氣體變成同狀況下理想氣體的焓之變化量 \((H^\circ_{m,id}-H^\circ_{m,re})\),亦可經由下列(a)、(b)、(c)三步驟完成,即 \(\Delta H_{m,a}+\Delta H_{m,b}+\Delta H_{m,c}\)。
其中(a)步驟,可經由熱力學的基本公式:\(\mathrm{d}H_m=T\mathrm{d}S_m+V\mathrm{d}p\),
在定溫下兩邊除於 \(\mathrm{d}p\),可得下式:\(\displaystyle (\frac{\partial H_m}{\partial p})_T=T(\frac{\partial S_m}{\partial p})_T+V_m\)
由馬克士威關係式(Maxwell relations)可知:\(\displaystyle (\frac{\partial S}{\partial p})_T=-(\frac{\partial V_m}{\partial T})_p\),
代入上式後再積分
\(\displaystyle (\frac{\partial H_m}{\partial p})_T=-T(\frac{\partial V_m}{\partial T})_p+V_m\)
\(\displaystyle \Delta H_{m,a}=-\int_{p^0}^0[T(\frac{\partial V_m}{\partial T})_p-V_m]\mathrm{d}p=\int_{0}^{p^0}[T(\frac{\partial V_m}{\partial T})_p-V_m]\mathrm{d}p\)
至於步驟(b)在壓力為 \(0~bar\) 時,分子間的引力為 \(0\),此時真實氣體和理想氣體相同,兩者的焓並無差異,因此 \(\Delta H_{m,b}=0\)。步驟(c)為等溫下,理想氣體從 \(0~bar\) 到 \(1~bar\),其焓的變化量亦為零\((\Delta H_{m,c}=0)\),因為理想氣體的焓僅為溫度的函數,與壓力無關。
經過上列推導,在 \(1~bar\) 下真實氣體變成理想氣體的焓的變化量為:
\(\displaystyle H^\circ_{m,id}-H^\circ_{m,re}=\Delta H_{m,a}+\Delta H_{m,b}+\Delta H_{m,c}=\int_0^{p^0}[T(\frac{\partial V_m}{\partial T})_p-V_m]\mathrm{d}p~~~(1)\)
上式中的 \((\frac{\partial V_m}{\partial T})_p\) 必須得知真實氣體之溫度和體積間的關係式才能做積分,一般較常用的為凡得瓦爾方程式(van der Waals equation)或伯特洛方程式(Berthelot’s equation),將其與維里方程式(virial equation)比較,經過適當簡化,便能求出 \((\frac{\partial V_m}{\partial T})_p\) 的關係,由於在低壓下使用伯特洛方程式所求得的相對焓,比凡得瓦爾方程式準確,因此我們使用前者繼續往下推導。
首先伯特洛方程式描述真實氣體的方程式如下:
\(\displaystyle p=\frac{RT}{V_m-b}-\frac{a}{TV_m^2}~~~~~~~~~(2)\)
它的表示法和凡得瓦爾方程式幾乎一樣,僅等式右邊第二項的分母多了一個 \(T\),因此雖為同一物質,其 \(a\)、\(b\) 的數值也和凡得瓦爾方程式的不一樣。事實上 \((2)\) 式要直接求出 \((\frac{\partial V_m}{\partial T})_p\) 的微分關係式相當複雜,因此要經過適當的轉換,先將 \((2)\) 式以壓縮因素(compress factor)表示
\(\displaystyle Z=\frac{pV_m}{RT}=(\frac{RT}{V_m-b}-\frac{a}{TV_m^2})\frac{V_m}{RT}=(\frac{1}{1-\frac{b}{V_m}}-\frac{a}{RT^2V_m})~~~~~~~~~(3)\)
由泰勒展開式可知
\(\begin{array}{l}\displaystyle \frac{1}{1-x}=1+x+x^2+x^3+\cdots & for~|x|<1\end{array}\)
\((2)\) 式中的 \(b\) 約略等於該氣體液態時的體積,因此其值顯然遠小於氣體的體積,因此 \(\frac{b}{V_m}<1\),
所以 \((3)\) 式中的 \(\frac{1}{1-\frac{b}{V_m}}\),若以泰勒展開式展開,則可表示如下:
\(\displaystyle Z=(\frac{1}{1-\frac{b}{V_m}}-\frac{a}{RT^2V_m})=1+(\frac{b}{V_m}-\frac{a}{RT^2V_m})+(\frac{b}{V_m})^2+(\frac{b}{V_m})^3+\cdots\)
上式若和下式以體積表示的維里方程式比較可看出,等號右邊的第二項應該相等
\(\displaystyle Z=\frac{pV_m}{RT}=1+\frac{B}{V_m}+\frac{C}{(V_m)^2}+\frac{D}{(V_m)^3}+\cdots~~~~~~~~~(4)\)
即 \(\displaystyle (\frac{b}{V_m}-\frac{a}{RT^2V_m})=(\frac{B}{V_m})\),所以可得下式:
\(\displaystyle B=b-\frac{a}{RT^2}~~~~~~~~~(5)\)
由上式可知,\((4)\) 式中的維里係數(virial coefficients) \(B\)、\(C\)、\(D\) 等均為 \(T\) 的函數。\((4)\) 式中的 \(B\) 值雖可透過伯特洛方程式中的 \(a\)、\(b\) 求出,但是 \((4)\) 式要將莫耳體積對溫度做微分,依舊非常困難,但是若使用以壓力表示的維里方程式則相對簡單,其表示法如下:
\(\displaystyle Z=\frac{pV_m}{RT}=1+B^\dagger(p)+C^\dagger(p)^2+D^\dagger(p)^3+\cdots~~~~~~~~~(6)\)
若對 \((6)\) 式移項,並將莫耳體積對溫度微分如下,當然其中的係數 \(B^\dagger,C^\dagger,D^\dagger\cdots\) 亦均為 \(T\) 的函數。
\(\displaystyle pV_m=RT[1+B^\dagger (p)+C^\dagger (p)^2+D^\dagger (p)^3+\cdots]~~~~~~~~~(7)\)
\(\displaystyle V_m=\frac{RT}{p}[1+B^\dagger (p)+C^\dagger (p)^2+D^\dagger (p)^3+\cdots]~~~~~~~~~(8)\)
\(\begin{multline*}\displaystyle (\frac{\partial V_m}{\partial T})_p=\frac{R}{p}[1+B^\dagger (p)+C^\dagger (p)^2+D^\dagger (p)^3+\cdots]\\+\frac{RT}{p}[\frac{\partial B^\dagger}{\partial T}p+\frac{\partial C^\dagger}{\partial T}p^2+\frac{\partial D^\dagger}{\partial T}p^3+\cdots]\end{multline*}\)
\(\displaystyle (\frac{\partial V_m}{\partial T})_p=\frac{R}{p}+R(B^\dagger+\frac{T\partial B^\dagger}{\partial T})+Rp(C^\dagger+\frac{T\partial C^\dagger}{\partial T})+\cdots\)
將上式乘 \(T\),並減 \(V_m\) (即以 \((8)\) 式代入):
\(\begin{array}{ll}\displaystyle T(\frac{\partial V_m}{\partial T})_p-V_m &=\begin{multline*}[\frac{RT}{p}+RT(B^\dagger+\frac{T\partial B^\dagger}{\partial T})+RTp(C^\dagger+\frac{T\partial C^\dagger}{\partial T})+\cdots]\\\displaystyle -[\frac{RT}{p}[1+B^\dagger p+C^\dagger (p)^2+\cdots ]] \end{multline*}\\&=\displaystyle[RT^2(\frac{\partial B^\dagger}{\partial T})+RT^2(\frac{p\partial C^\dagger}{\partial T})+\cdots]\end{array}\)
將上式代入 \((1)\) 式並積分:
\(\begin{array}{ll}\displaystyle H^\circ_{m,id}-H^\circ_{m,re}&=\displaystyle\int_0^{p^0}[T(\frac{\partial V_m}{\partial T})_p-V_m]\mathrm{d}p\\&=\displaystyle\int_0^{p^0}[RT^2(\frac{\partial B^\dagger}{\partial T})+RT^2(\frac{p\partial C^\dagger}{\partial T})+\cdots]\mathrm{d}p\end{array}\)
\(\displaystyle H^\circ_{m,id}-H^\circ_{m,re}=RT^2[(\frac{\partial B^\dagger}{\partial T})p^0+\frac{1}{2}R(\frac{\partial C^\dagger}{\partial T})(p^0)^2+\cdots]~~~~~~~~~(9)\)
據經驗當標準壓力為 \(1~bar\) 時,上式 \(p^0\) 高於 \(2\) 次方者均可忽略不計,因此 \((9)\) 式僅和 \(B^\dagger\) 有關,若能求出其關係式則答案便迎刃而解。目前為止我們雖不知 \(B^\dagger\),但是由 \((5)\) 式卻知道 \(B\) 的關係式,因此只要再求出 \(B\)和 \(B^\dagger\) 的關係,則 \((9)\) 式的解答便向前邁進一大步。
將 \((4)\) 式簡化如下:
\(\begin{array}{ll}\displaystyle pV_m &=\displaystyle RT[1+\frac{B}{V_m}+\frac{C}{(V_m)^2}+\frac{D}{(V_m)^3}+\cdots]~~~~~~~~~(4)\\p&=\displaystyle RT[\frac{1}{V_m}+\frac{B}{(V_m)^2}+\frac{C}{(V_m)^3}+\frac{D}{(V_m)^4}+\cdots]\end{array}\)
再將上式代入 \((7)\) 式
\(\begin{multline*} \displaystyle pV_m=RT\Big\{ 1+B^\dagger\Big[RT[\frac{1}{V_m}+\frac{B}{(V_m)^2}+\frac{C}{(V_m)^3}+\frac{D}{(V_m)^4}+\cdots]\Big]\\\displaystyle +C^\dagger\Big[RT[\frac{1}{V_m}+\frac{B}{(V_m)^2}+\frac{C}{(V_m)^3}+\frac{D}{(V_m)^4}+\cdots] \Big]^2+\cdots \Big\}\end{multline*}\)
\(\displaystyle pV_m=RT\Big\{1+\frac{B^\dagger RT}{V_m}+\frac{B^\dagger BRT+C^\dagger R^2T^2}{(V_m)^2}+\cdots \Big\}~~~~~~~~~(10)\)
由 \((4)\) 式和 \((10)\) 式相互比較,可得 \(B=B^\dagger RT\),將 \((5)\) 式代入即可得知 \(B^\dagger\) 和 \(a\)、\(b\) 間的關係如下:
\(\displaystyle B=B^\dagger RT=b-\frac{a}{RT^2}\) ,所以 \(\displaystyle B^\dagger=\frac{b}{RT}-\frac{a}{R^2T^3}\)
將上式對 \(T\) 微分:\(\displaystyle \frac{\partial B^\dagger}{\partial T}=\frac{-b}{RT^2}+\frac{3a}{R^2T^4}\),左式代入 \((9)\) 式(只保留含 \(p^0\) 的項目)
\(H^\circ_{m,id}-H^\circ_{m,re}\approx RT^2 \Big[ (\frac{\partial B^\dagger}{\partial T})p^0 \Big]\approx RT^2\Big[(\frac{-b}{RT^2}+\frac{3a}{R^2T^4}) \Big]p^0\)
\(H^\circ_{m,id}-H^\circ_{m,re}\approx (\frac{3a}{RT^2}-b)p^0~~~~~~~~~(11)\)
由 \((11)\) 式可知,只要知道欲求氣體在伯特洛方程式中的 \(a\)、\(b\) 值,便能求出答案。
連結:標準狀況下理想氣體與真實氣體間的焓值差-以C2H6為例 (二)
參考文獻
- N. Levine(1988), Physical Chemistry (3rd ed.). p211~225, McGRAW-HILL Book Company.
- 標準狀況下理想氣體與真實氣體間的熵值差-以SO2為例,高瞻計畫資源平台,http://highscope.ch.ntu.edu.tw/wordpress/?s=邱智宏


 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池  油理油趣─淺談食油的化學
油理油趣─淺談食油的化學  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  化學傳記:法拉第不為人知的一面(五):兩個演講會
化學傳記:法拉第不為人知的一面(五):兩個演講會  【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象
【2016年諾貝爾物理獎特別報導】物質在平面世界裡的奇異現象  【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法 
