麥克默里反應偶合反應
麥克默里反應偶合反應(McMurry coupling)
國立臺灣師範大學化學系碩士生 賴羽庭
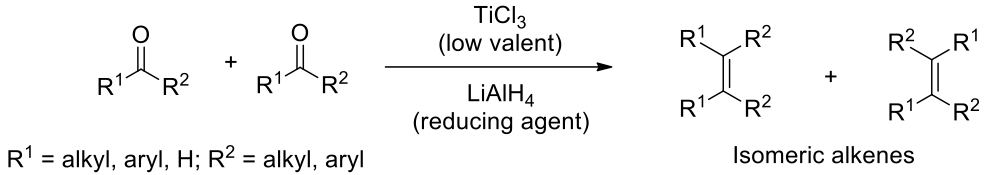
在 1970 年代初期,約翰.愛德華.麥克默里 (John Edward McMurry)(圖一)、向山光昭 (Teruaki Mukaiyama) 等人,分別發現利用羰基化合物與低價的鈦進行反應可得到烯烴偶合產物。在隨後幾年,麥克默里研究其使用範圍、方法和限制,1而今日使用低價鈦錯合物還原偶合羰基化合物形成相應的烯烴的方法被稱為麥克默里偶合反應 (McMurry coupling)(圖二)。1-17
約翰.愛德華.麥克默里生於 1942 年 7 月 27 日於紐約市,為康奈爾大學化學與化學生物學的名譽教授。1964 年哈佛大學得到學士學位;於 1967 年,在吉爾伯特.斯托克 (Gilbert Stork) 教授的團隊下工作獲得博士學位。在他的博士學位後,加入了美國加州大學聖克魯斯分校任教;於 1980 年轉至康奈爾大學。16
麥克默里偶合反應一般的特點:
- 常用於醛類或是酮類的自偶合反應 (homocoupling) 來得到烯烴。然而,若同一種化合物加入過量或是其中一化合物為二芳基酮亦可進行偶合。
- 低價數的鈦試劑可以經由很多方式製備,最常用的方式為利用三氯化鈦與鋅銅偶 (Zn-Cu) 還原劑在乙二醇二甲醚 (dimethoxyethane) 為溶劑下製備取得。1
- 如果反應條件是在低溫下進行,則【酉品】(pinacol) 中間體可以被分離;若在高溫下進行反應則會直接形成烯烴。
- 在其他方法因具有立體阻礙而無法製備的的烯烴(如:四取代的烯烴)在此皆可得到很高的產率。
- 在高度稀釋的條件下能成功的合成中型和大型環。
- 分子內合環反應形成五環或六環的反應是最快的,而形成八環或更高的環數則會相當的慢。
- 反應條件不允許容易還原的官能基,如:環氧化合物 (epoxides)、鹵代酮 (α-halo ketones)、未受保護的 1,2- 二醇、烯丙基和苯甲基醇、醌、鹵代醇、芳香族和脂肪族硝基化合物、肟、亞碸;大多數其它官能基是兼容的。
- 醛類比酮類反應快許多,所以兩種醛類的偶合反應就算有一種酮類的存在下也能有化學選擇性。
- 烯烴產物的形成有較差的立體選擇性,儘管如此在分子間的反應中還是稍微偏愛形成 (E)- 烯烴的形式。
- 麥克默里反應偶合反應在氯矽烷 (chlorosilane) 的條件下可被催化。15
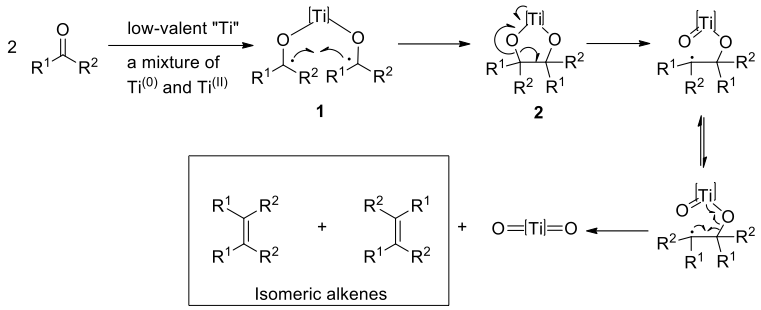
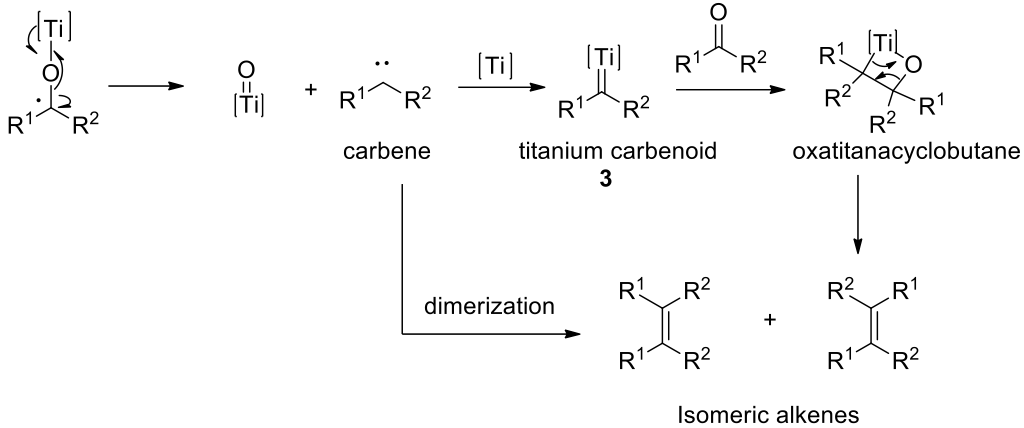
麥克默里反應偶合反應的反應機構,1-12,14目前尚未完全清楚,但還原偶合可以看作有兩個步驟:(1)【酉品】的形成、(2) 脫氧作用形成烯烴(圖三)。經由廣泛的研究顯示低價鈦最有可能的為 $$+2$$ 價和零價,而生成物種的比例取決於製備的方法(溶劑、溫度、還原劑等)。最近的研究發現,該反應可能涉及到碳烯 (carbene) 或金屬類碳烯 (metal carbenoid) 的形成。6-8, 14中間體的性質主要取決於羰基的結構和反應條件。
兩個羰基化合物經由低價鈦還原形成兩個鈦羰自由基 (titanium ketyl radicals) 1,接著 1 偶合得到鈦【酉品】五員環中間體 2,再進行脫去氧化得到同分異構物的烯烴產物(圖四)。
若在立體阻礙較大的酮類,則有可能不會形成五員環中間體 2,而是形成類碳烯 (carbenoid) 結構的中間體 3。
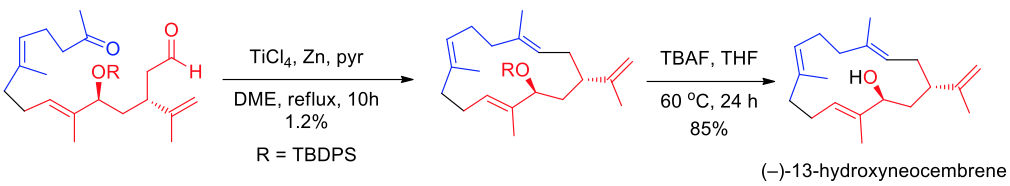
應用方面,Y. Li 及其工作團隊為第一個應用分子內麥克默里反應偶合反應作為重要的步驟進行大環化 (macrocyclization) 得到具有鏡像選擇性的全合成產物 (–)-13-hydroxyneocembrene。此外為了避免分子間的偶合所以在高度稀釋的環境下進行,最後一步再利用四正丁基氟化銨 (TBAF) 去掉甲矽烷基保護基得到產物(圖五)。13
參考文獻
- McMurry, J. E., Fleming, M. P., Kees, K. L., & Krepski, L. R. (1978). Titanium-induced reductive coupling of carbonyls to olefins. The Journal of Organic Chemistry, 43(17), 3255-3266.
- Fujiwara, Y., Ishikawa, R., Akiyama, F., & Teranishi, S. (1978). Reductive Coupling of Carbonyl Compounds to Olefins by Tungsten Hexachloride-Lithium Aluminum Hydride and Some Tungsten and Molybdenum Carbonyls. The Journal of Organic Chemistry, 43(12), 2477-2480.
- Dams, R., Malinowski, M., & Geise, H. J. (1981). Reductive Couplings of Ketones by Low‐Valent Titanium, Prepared from TiCl4 and Reducing Agents. Bulletin des Sociétés Chimiques Belges, 90(11), 1141-1152.
- Dams, R., Malinowski, M., & Geise, H. J. (1982). Reductive couplings with low-valent titanium compounds (McMurry Reaction). An esr investigation into the TiCl3/LiAlH4/ROH system. Transition Metal Chemistry, 7(1), 37-40.
- Dams, R., Malinowski, M., Westdorp, I., & Geise, H. (1982). On the mechanism of the titanium-induced reductive coupling of ketones to olefins. The Journal of Organic Chemistry, 47(2), 248-259.
- Bryan, J. C., & Mayer, J. M. (1990). Oxidative addition of carbon-oxygen and carbon-nitrogen double bonds to WCl2 (PMePh2) 4. Synthesis of tungsten metallaoxirane and tungsten oxo-and imido-alkylidene complexes. Journal of the American Chemical Society, 112(6), 2298-2308.
- Chisholm, M. H., Folting, K., & Klang, J. A. (1990). Reaction between benzophenone and ditungsten hexaalkoxides. Molecular structure and reactivity of W (OCH2-tert-Bu) 4 (py)(. eta. 2-OCPh2). Organometallics, 9(3), 607-613.
- Chisholm, M. H., Folting, K., & Klang, J. A. (1990). Reductive cleavage of ketonic carbon-oxygen bonds in the reactions between ketones and ditungsten hexaalkoxides. Structural characterization of a ditungsten. mu.-propylidene derivative. Organometallics, 9(3), 602-606.
- Pierce, K. G., & Barteau, M. A. (1995). Ketone coupling on reduced TiO2 (001) surfaces: evidence of pinacol formation. The Journal of Organic Chemistry, 60(8), 2405-2410.
- Villiers, C., & Ephritikhine, M. (1997). New Insights into the Mechanism of the McMurry Reaction. Angewandte Chemie International Edition in English, 36(21), 2380-2382.
- Sherrill, A. B., Lusvardi, V. S., Eng, J., Chen, J. G., & Barteau, M. A. (2000). NEXAFS investigation of benzaldehyde reductive coupling to form stilbene on reduced surfaces of TiO 2 (0 0 1). Catalysis today, 63(1), 43-51.
- Villiers, C., & Ephritikhine, M. (2001). Reactions of Aliphatic Ketones R2CO (R= Me, Et, iPr, and tBu) with the MCl4/Li (Hg) System (M= U or Ti): Mechanistic Analogies between the McMurry, Wittig, and Clemmensen Reactions. Chemistry–A European Journal, 7(14), 3043-3051.
- Liu, Z., Zhang, T., & Li, Y. (2001). First enantioselective total synthesis of (−)-13-hydroxyneocembrene. Tetrahedron Letters, 42(2), 275-277.
- Ephritikhine, M. (1998). A new look at the McMurry reaction. Chemical Communications, (23), 2549-2554.
- Herrmann, W. A., Schneider, H. (2002) Catalytic McMurry coupling: olefins from keto compounds. Applied Homogeneous Catalysis with Organometallic Compounds (2nd Edition), 3, 1093-1099.
- John Edward McMurry –Wikipedia. https://en.wikipedia.org/wiki/John_E._McMurry
- Kurti, L., & Czakó, B. (2005). Strategic applications of named reactions in organic synthesis. Elsevier. pp.276 -277.



 前一篇文章
前一篇文章 下一篇文章
下一篇文章 原子序第113超重元素的發現與命名
原子序第113超重元素的發現與命名  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  【2016年諾貝爾化學獎特別報導】如何將分子變成機器
【2016年諾貝爾化學獎特別報導】如何將分子變成機器  目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破
目前世界上最精準的時鐘-光晶格光頻原子鐘在低溫環境下的突破  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  謎樣的分子:克里奇中間體
謎樣的分子:克里奇中間體  【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中
【2017年諾貝爾化學獎特別報導】將生命捕捉在原子的細節中  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第 
