氧氮環丙烷(上)
氧氮環丙烷(上)(Oxaziridine (I))
國立臺灣師範大學化學系碩士班 洪嘉駿
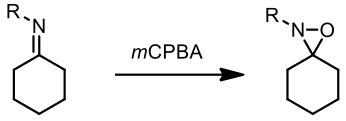
氧氮環丙烷 (oxaziridine) 是由氮原子、氧原子和碳原子所組成的三員雜環有機化合物,也是合成反應中常用的親電試劑以及生產聯胺時會產生的中間物。氧和氮因為其電負度高的緣故一般來說常常作為親核試劑加成,但是由於氧氮環丙烷極高度的三員環環張力以及相對較弱的氮-氧鍵,所以此類化合物便作為親電試劑,也就是氧原子或是氮原子的提供者;氧氮環丙烷上的碳原子並不會被親電試劑直接加成,通常是直接與環上的氧原子或氮原子反應。
氧氮環丙烷的製備方式通常是將亞胺利用過氧化物(例如 mCPBA)氧化:
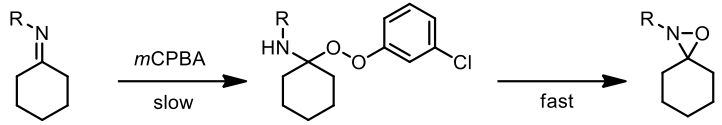
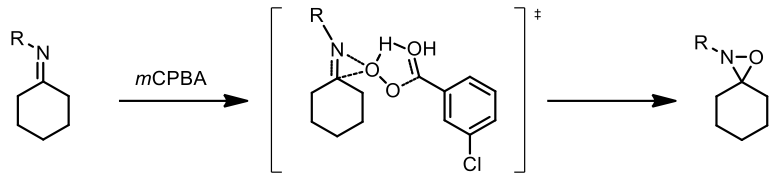
而機制如圖二所示的兩種可能,而大家較普遍接受兩階段機制為此反應的機制 [1]。
(1) 兩階段機制(拜耳-維立格型)
(2) 協同機制 (concerted mechanism)
圖二、氧氮環丙烷的製備的反應機制。(作者繪製)
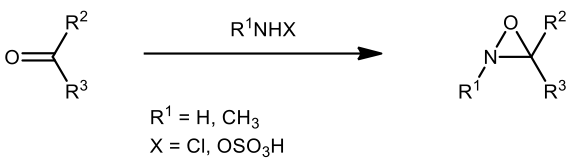
D. Emmons 於 1950 年代中期首先發明氧氮環丙烷的製造方法:利用亞胺化合物 (imine) 及過氧酸化合物 (peroxyacids) 以環氧化方式合成。直到了現今除了上述方法外還有以羰基化合物氧化亞胺的方法獲得 [2]。
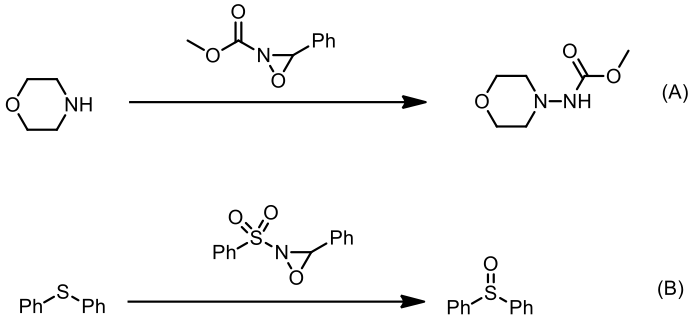
氧氮環丙烷上的基團可以影響其性質,使其偏向提供氧原子或提供氮原子的功能,一是看基團的拉電子能力,二是端看於氮上的取代基的立體障礙大小而決定了此化合物是以氧還是氮為親核中心,如圖二所示:若是氮上的取代基的立體障礙小(氫原子或甲基)且氮原子上的基團拉電子能力較小則親核試劑會進攻氮原子,氧氮環丙烷作為氮轉移試劑提供氮原子(圖四 —A);反之則親核試劑會進攻氧原子,提供氧原子作為氧轉移試劑(圖四 —B)[3]。
氧轉移試劑:
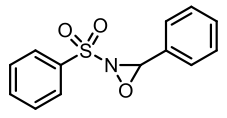
在許多氧氮環丙烷之中有個特別的結構被稱為「戴維斯氧氮環丙烷 (Davis oxaziridine)」,用來當作氧原子的提供者,無論是羥基化反應或式環氧化反應都是很好用的試劑。若是氮原子上接的是磺醯基基團 (sulfonyl group) 則我們將之稱為戴維斯氧氮環丙烷,例如 3—苯基—2—(苯磺醯基)—1, 2—氧氮環丙烷 [4]:
作為氧轉移試劑的氧氮環丙烷有以下幾種常見的用途:α —羥基化反應、烯烴的一般環氧化反應、選擇性環氧化反應及硫化物的氧化反應。
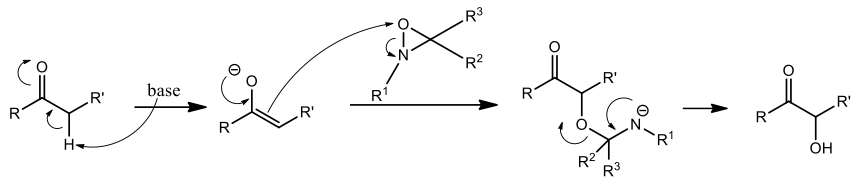
1. α —羥基化反應
酮類化合物上 α 位碳上的氫是酸度最高的一個氫,利用鹼(例如 NaHMDS)將其拔除後 α 位碳便帶有負電,負電電子進攻氧氮環丙烷的氧原子,最後形成 α 位上帶有羥基的醯醇(或稱酮醇、醯偶姻)化合物 [5]。機制如下圖所示:
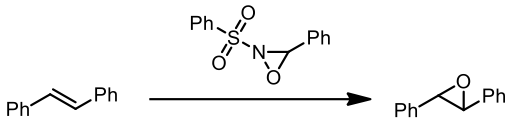
2.烯烴的環氧化反應 [6]
不同取代基的氧氮環丙烷對於烯烴的反應活性排序如下:
不同取代基的氧化劑與 N-磺醯基取代的氧氮環丙烷反應活性排序如下:
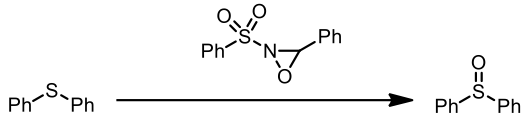
3.硫化物的氧化反應
連結:氧氮環丙烷(下)
參考文獻
- Ogata, Y., & Sawaki, Y. (1973). Peracid oxidation of imines. Kinetics of oxazirane formation from benzylidene-tert-butylamines and perbenzoic acid. Journal of the American Chemical Society, 95(14), 4687-4692.
- Emmons, W. D. (1956). The synthesis of oxaziranes. Journal of the American Chemical Society, 78(23), 6208-6209.
- (a) Davis, F. A., Billmers, J. M., Gosciniak, D. J., Towson, J. C., & Bach, R. D. (1986). Chemistry of oxaziridines. 7. Kinetics and mechanism of the oxidation of sulfoxides and alkenes by 2-sulfonyloxaziridines. Relationship to the oxygen-transfer reactions of metal peroxides. The Journal of Organic Chemistry, 51(22), 4240-4245.
- (b) Vidal, J., Damestoy, S., Guy, L., Hannachi, J. C., Aubry, A., & Collet, A. (1997). N‐Alkyloxycarbonyl‐3‐aryloxaziridines: Their Preparation, Structure, and Utilization As Electrophilic Amination Reagents. Chemistry–A European Journal, 3(10), 1691-1709.
- Davis, F. A., Lal, S. G., & Durst, H. D. (1988). Chemistry of oxaziridines. 10. Selective catalytic oxidation of sulfides to sulfoxides using N-sulfonyloxaziridines. The Journal of Organic Chemistry, 53(21), 5004-5007.
- Evans, D. A., Morrissey, M. M., & Dorow, R. L. (1985). Asymmetric oxygenation of chiral imide enolates. A general approach to the synthesis of enantiomerically pure. alpha.-hydroxy carboxylic acid synthons. Journal of the American Chemical Society, 107(14), 4346-4348.
- Davis, F. A., & Sheppard, A. C. (1989). Applications of oxaziridines in organic synthesis. Tetrahedron, 45(18), 5703-5742.


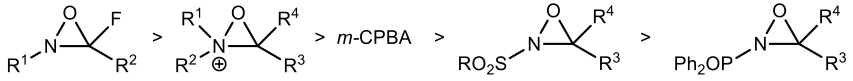

 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法
【2014諾貝爾化學獎深入報導】 打破光學顯微鏡的解析度極限-超高解析螢光顯微法  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定
【2015諾貝爾化學獎特別報導】DNA修補─為生命提供化學的穩定  莫耳和公斤單位的重新定義
莫耳和公斤單位的重新定義  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第  暖暖包的原理
暖暖包的原理  化學的填字遊戲?
化學的填字遊戲? 
