化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔I〕
化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔I〕
國立彰化師範大學化學系碩士生陳少軍和陳永祥 / 國立彰化師範大學化學系楊水平副教授責任編輯
學生講義之一(Student Handout I)
化學示範
老師示範「阿拉丁神燈」,學生觀察變化的現象,老師與學生互動討論變化現象的化學原理。
實驗介紹
本實驗的目的是利用自制的熱卡計(calorimeter)來測定過氧化氫分解成為液態水和氧氣的分解焓。
熱化學(Thermochemistry)是研究能量和熱量與化學反應和/或物理變化的科學。一個反應可能釋放或吸收能量,相的變化亦同,如熔化和沸騰。熱化學聚焦在能量的變化,特別是對系統與其周遭環境的能量交換。化學反應的能量變化包括酸鹼中和熱、燃燒熱、形成熱、分解熱和各式各樣的反應熱。若以特定的1莫耳反應物或產物的能量變化,則熱化學上以焓(enthalpy)表示,如酸鹼反應生成1莫耳的水所放出的熱,稱為酸鹼中和焓,1莫耳的過氧化氫分解成為液態水和氧氣所放出的熱,稱為過氧化氫的分解焓。
熱卡計是一種用於測量化學反應或物理變化的熱量變化之裝置,是一個很好的絕熱裝置,可以有效地避免反應跟它的周遭環境的熱交換。當反應在熱卡計中以熱釋放 時,熱卡計內的內容物之溫度也會改變,此溫度的變化是可以被測量的,而且與反應的熱量變化有關。在實驗室內,使用的簡單熱卡計並非完全的絕熱裝置,因此, 反應的熱量變化也會被熱卡計吸收或放出。
熱卡計必須測定其熱容量(heat capacity)來校正。亦即,藉由熱卡計上升或下降攝氏1度所吸收或放出的熱量來校正。本實驗利用熱水和室溫水來測定熱卡計的熱容量。
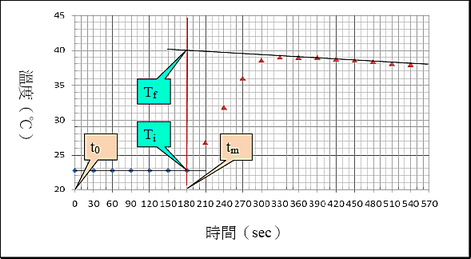
由於沒有任何一個熱卡計不會洩漏熱量,因此在觀察溫度的變化過程中,某些熱損失到外界是可能的。圖一顯示在一個放熱反應的過程中,利用熱卡計得到的溫度與時間之關係圖,設在反應物混合之時間為tm。在反應之前(tm之前),溫度保持恆定,藉由趨勢線可正推到開始混合或開始反應時(tm之時)的溫度(Ti)。在反應之後(tm之後),由於混合或反應後放出熱量,溫度急遽的上升。然後,由於熱卡計的熱損失,溫度開始下降。當溫度達到平衡時,熱損失逐漸穩定,溫度的下降呈現線性。藉由此線性,可以倒推到tm的時間點而得到最大值的溫度(Tf),進而推知反應發生平衡的瞬間溫度。圖一的趨勢線倒推而得到瞬間溫度為39.9 ℃。一旦Ti和Tf兩溫度由趨勢線推知,混合或反應的前後溫度差就可以得知,因此測定熱卡計的熱容量是可能的。
化學反應後,混合物(反應的溶液)所吸收的熱等於質量(m) × 比熱(S) × 溫度差(△T),此處m為混合物的質量(g),S為混合物的比熱(J/℃‧g),△T為混合物反應前後的溫度差(℃)。在本次實驗中,假設純水和所有反應的水溶液之比熱(specific heat capacity)均為0.00418 kJ/℃‧g。
藥品和器材
1. 發泡保利龍杯(Styrofoam cups,容量360 mL) 2個/組
2. 剪刀(小支) 1支/組
3. 塑膠直尺(15 cm)1支/組
4. 衛生筷 1支/組
5. 溫度計(100 ℃) 2支/組
6. 燒杯(100 mL、250 mL和500 mL) 各1個/組
7. 量筒(25 mL和50 mL)各1個/組
8. 塑膠PE滴管(3 mL) 1支/組
9. 蒸餾水 20 mL/組
10. 電子天平(0.001 g或更精確) 1台
11. 碘化鉀(Potassium iodide, KI) 4.0 g
12. 碳酸鈉(Sodium carbonate, Na2CO3) 4.0 g
13. 手錶(有秒針)或碼表 1支/組
自製熱卡計
1. 取一個發泡保利龍杯,距離杯底2.0 cm處用小刀裁剪成小型平底盤狀。注意:剪裁處必須剪齊,不可凹凸不平。用一支衛生筷施力重壓此平底盤的中央處,戳成一個直徑約0.5 cm的小孔洞(稍小於溫度計直徑0.7 cm),如圖二所示。
2. 然後,手持一支溫度計從平底盤的背面慢慢地以旋轉方式插入,形成一個熱卡計的杯蓋,如圖三所示。
3. 取二個發泡保利龍杯並且重疊在一起,形成一個熱卡計的容器(杯身)。固定此容器在一個500 mL的燒杯中,如圖四所示。
4. 放置杯蓋在熱卡計的容器(杯身)中,調整溫度計的球徑高度恰好接觸到熱卡計的杯底。然後,測試杯蓋是否可以與容器緊密接觸,若不緊密,則施以小力輕輕壓下杯蓋,使杯蓋與容器緊密接觸,形成一個接近絕熱的自製熱卡計,如圖五所示。
實驗步驟
A. 測定熱卡計的熱容量
1. 用量筒量取25.0 mL的室溫水,然後用一支溫度計測量溫度,每30秒讀取一次,直到溫度差不大於±0.1 ℃(溫度大致維持恆溫)。然後,與第3步驟同時開始計時(t0),每30秒讀取溫度一次,並紀錄其溫度3分鐘於表一。在第4分鐘開始(第180秒,tm)時,倒入第3步驟的熱卡計中。
2. 取一個自製熱卡計,以衛生紙擦乾水分,用另一支量筒量取25.0 mL的熱水(水溫約高於室溫約40-45℃),倒入熱卡計中,緊密地蓋上一個連接溫度計的杯蓋。【注意:必須蓋緊,否則熱量易流失。】然後,手持燒杯以每 秒來回一次的方式,在桌上搖晃約兩分鐘,促使水與熱卡計達到熱平衡(溫度維持穩定緩慢下降)。
3. 當熱水的水溫穩定緩慢下降時,開始計時(t0),每30秒讀取溫度一次,並紀錄其溫度3分鐘。然後,在第4分鐘開始(第180秒,tm)時,倒入步驟1的室溫水,並且立即緊密地蓋上杯蓋。【注意:必須蓋緊,否則熱量易流失。】然後,手握燒杯以每秒來回一次的方式在桌上搖晃約三分鐘,促使混合均勻。在混合後,每30秒讀取溫度一次,並紀錄其溫度5分鐘(或直到溫度維持穩定地緩慢下降為止)於表一。
4. 計算熱卡計的熱容量。
B. 測定二固體的溶解熱
1. 精確地稱取2.0 g的碘化鉀和2.0 g的碳酸鈉,紀錄重量。此二固體置入一個小燒杯中並混合均勻。
2. 取一個自製熱卡計,以衛生紙擦乾水分,用一支量筒量取50.0 mL室溫的蒸餾水並倒入熱卡計中,緊密地蓋上一個連接溫度計的杯蓋。然後,用溫度計測量溫度,直到溫度差不大於±0.1℃,開始計時(t0),每30秒讀取溫度一次,並紀錄其溫度3分鐘於表二。
3. 在第4分鐘開始(第180秒,tm)時,倒入混合的固體到熱卡計中,並且立即緊密地蓋上杯蓋。【注意:必須蓋緊,否則熱量易 散失。】然後,手握燒杯以每秒來回一次的方式,在桌上搖晃約三分鐘,促使固體快速溶解且混合溶液均勻。在混合後,每30秒讀取溫度一次,並紀錄其溫度5分 鐘(或直到溫度維持穩定地緩慢下降為止)於表二。
4. 計算碘化鉀和碳酸鈉固體的溶解熱。
C. 測定過氧化氫的分解熱和固體的溶解熱
1. 精確地秤取2.0 g的碘化鉀和2.0 g的碳酸鈉,紀錄重量。此二固體置入一個小燒杯中並混合均勻。
2. 先取一支100 mL的量筒並扣除毛重,再量取50.0 mL的外用雙氧水,秤重此雙氧水。紀錄重量和體積以及此的雙氧水廠牌和含量。
3. 取一個自製熱卡計,以衛生紙擦乾水分。倒入50.0 mL的外用雙氧水於熱卡計中,緊密地蓋上一個連接溫度計的杯蓋。等待溫度差不大於±0.1 ℃後,開始計時(t0),每30秒讀取溫度一次,並紀錄其溫度3分鐘於表三。
4. 在第4分鐘開始(第180秒,tm)時,倒入混合的固體到熱卡計中,並且立即緊密地蓋上杯蓋。【注意:必須蓋緊,否則熱量易 流失。】然後,手握燒杯以每秒來回一次的方式,在桌上搖晃約五分鐘,促使固體快速溶解且混合溶液均勻。在混合後,每30秒讀取溫度一次,並紀錄其溫度10 分鐘(或直到溫度維持穩定地緩慢下降為止)於表三。
5. 計算過氧化氫的分解熱與固體的溶解熱之和、過氧化氫的分解熱,以及過氧化氫的分解焓。
安全和注意
● 進行實驗操作時,應該戴安全眼鏡及可丟棄的手套,也應該穿實驗衣。
● 若對實驗的安全問題有任何質疑,請勿猶豫,立刻詢問老師。
● 不慎接觸藥品,應該用大量水沖洗,必要時報告老師。
廢棄物處理
● 剪裁不用的發泡保利龍杯:集中於標示「廢棄塑膠」的大塑膠袋中。
● 溶解和反應後的混合溶液:集中於標示「無機物」的大塑膠桶中。






 前一篇文章
前一篇文章 下一篇文章
下一篇文章 【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間
【2013諾貝爾獎特別報導】化學獎:將實驗帶入網際空間 ![[影音] CASE【百秒說科學】《交叉分子束》](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2016/11/CMB-620x280-科學Online.jpg) [影音] CASE【百秒說科學】《交叉分子束》
[影音] CASE【百秒說科學】《交叉分子束》  化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第
化學傳記:法拉第不為人知的一面(最終回):晚年的法拉第 ![[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講](https://highscope.ch.ntu.edu.tw/wordpress/wp-content/uploads/2015/10/Aaron-Ciechanover222.png) [講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講
[講座] Aaron Ciechanover 教授(2004諾貝爾化學獎得主)醫藥通俗演講  利用奈米粒子高效率吸收太陽能
利用奈米粒子高效率吸收太陽能  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法 
