化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔IV〕
化學實驗室實驗:過氧化氫分解焓的測定(Determination of the Decomposition Enthalpy of Hydrogen Peroxide)〔IV〕
國立彰化師範大學化學系碩士生陳少軍和陳永祥 / 國立彰化師範大學化學系楊水平副教授責任編輯
教師手冊之二(Teacher’s Guide II)
實驗紀錄樣本
一、 化學示範
1. 寫出此示範實驗的變化現象。
老師輕輕地打開水壺的壺蓋並且立即蓋上,隨即在壺嘴快速地冒出大量的白色煙霧,並且發出鳴叫聲。用手觸摸一下水壺感覺很燙。
2. 說明變化現象的化學原理。
這些變化現象是因為雙氧水分解放出大量的熱量,造成溶液內的水沸騰而冒出大量的白色煙霧,並且溫度高達100 ℃,用手觸摸一下水壺感覺很燙。
二、 過氧化氫的分解焓
A. 測定熱卡計的熱容量
● 熱水的體積: 25.0 mL,質量: 25.0 g
● 室溫水的體積: 25.0 mL,質量: 25.0 g
表一-A 熱水的時間與溫度之數據
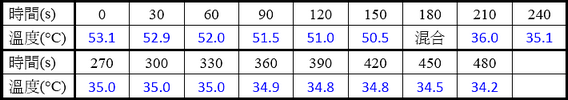 表一-B 室溫水的時間與溫度之數據
表一-B 室溫水的時間與溫度之數據

● 轉化表一-A和表一-B的實驗數據成為圖六,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖六上。
在混合時(tm)熱水的溫度(Tih): 49.9 ℃(由趨勢線的正推而得知)
在混合時(tm)室溫水的溫度(Tir): 19.3 ℃(由趨勢線的正推而得知)
在混合時(tm)溫水的溫度(Tf): 35.2 ℃(由趨勢線的倒推而得知)
在混合時(tm)熱水與溫水的溫度差(Tih – Tf): 14.7 ℃
在混合時(tm)室溫水與溫水的溫度差(Tf – Tir): 15.9 ℃
熱水所放出的熱量:比熱 × 質量 × 溫度差 = 0.00418 kJ/g℃ × 25.0 g × 14.7℃ = 1.54 kJ
室溫水所吸收的熱量:比熱 × 質量 × 溫度差 = 0.00418 kJ/g℃ × 25.0 g × 15.9℃ = 1.66 kJ
卡熱計放出的熱量:室溫水所吸收的熱 – 熱水所放出的熱 = 1.66 kJ – 1.54 kJ = 0.12 kJ
卡熱計的熱容:卡熱計放出的熱量 / 卡熱計下降的溫度 = 0.12 kJ / 14.7℃ = 0.0082 kJ/℃
B. 測定二固體的溶解熱
● 碘化鉀的質量: 2.0198 g,碳酸鈉的質量: 2.0370 g
● 室溫水的體積: 50.0 mL,質量: 50.0 g
● 轉化表二的實驗數據成為圖七,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖七上。
在混合時(tm)室溫水的溫度(Ti): 18.2 ℃(由趨勢線的正推而得知)
在混合時(tm)溶液的溫度(Tf): 18.9 ℃(由趨勢線的倒推而得知)
在混合時(tm)室溫水與溶液的溫度差(Tf – Ti): 0.7 ℃
溶液總質量:水的質量 + 二固體的質量 = 50.0 g + 2.0198 g + 2.0370 g = 54.1 g
溶液所吸收的熱量:比熱 × 質量 × 溫度差 = 0.00418 kJ/g℃ × 54.1 g × 0.7℃ = 0.2 kJ
卡熱計所吸收的熱量:卡熱計的熱容 × 溫度差 = 0.0082 kJ/℃ × 0.7℃ = 0.006 kJ
二固體的溶解熱:-(溶液吸收的熱量 + 熱計吸收的熱量) = -(0.2 kJ + 0.006 kJ) = -0.2 kJ
C. 測定過氧化氫的分解熱和二固體的溶解熱
● 雙氧水的廠牌: 天乾牌 ,用途: 傷口消毒用 ,雙氧水的含量: 30 mg H2O2/mL
● 雙氧水的體積: 50.0 mL ,質量: 50.8383 g
● 過氧化氫的莫耳質量: 34.0147 g/mol(請到網路搜尋或向老師詢問)
● 過氧化氫的分解焓(文獻值): -98.1 kJ/mol(請到網路搜尋或向老師詢問)
● 碘化鉀的質量: 2.0948 g,碳酸鈉的質量: 2.0263 g
● 轉化表三的實驗數據成為圖八,並且寫出橫軸和縱軸的變因和單位,標示刻度,以及畫出趨勢線,讀出Ti和Tf。可用MS-Excel製作圖表,列印後貼在圖八上。
在混合時(tm)雙氧水的溫度(Ti): 18.9 ℃(由趨勢線的正推而得知)
在混合時(tm)溶液的溫度(Tf): 38.6 ℃(由趨勢線的倒推而得知)
在混合時(tm)雙氧水與溶液的溫度差(Tf – Ti): 19.7 ℃
溶液總質量:雙氧水的質量 + 二固體的質量 = 50.8383 g + 2.0948 g + 2.0263 g = 54.9594 g
溶液所吸收的熱量:比熱 × 質量 × 溫度差 = 0.00418 kJ/g℃ × 54.9594 g × 19.7℃ = 4.53 kJ
卡熱計所吸收的熱量:卡熱計的熱容 × 溫度差 = 0.0082 kJ/℃ × 19.7℃ = 0.16 kJ
雙氧水的分解熱與二固體的溶解熱之和:
-(溶液所吸收的熱量 + 卡熱計所吸收的熱) = -(4.53 kJ + 0.16 kJ) = -4.69 kJ
雙氧水的分解熱:
雙氧水的分解熱與二固體的溶解熱之和 – 二固體的溶解熱 = -4.69 kJ – (-0.2 kJ) = -4.5 kJ
過氧化氫的莫耳數:
(體積 × 含量) / 莫耳質量 = [50.0 mL × (30. mg/mL) × (1 g/1000 mg)] / 34.0147 g/mol = 0.044 mol
過氧化氫的分解焓(測量值):
雙氧水的分解熱 / 過氧化氫的莫耳數 = -4.5 kJ / 0.044 mol = -100 kJ/ mol
過氧化氫的分解焓(文獻值): -98.1 kJ/mol(請到網路搜尋或向老師詢問)
實驗誤差:
(測量值 – 文獻值) / 文獻值 × 100% = [-100 kJ/ mol – (-98.1 kJ/mol) / -98.1 kJ/mol] × 100% = -2%
參考答案
1. 從熱化學式告訴我們,1 mole的過氧化氫分解焓是-98.1 kJ,而且1 mol H2O2 = 34.0 g H2O2。因此,1.00 g的過氧化氫的分解熱 = 1.00 g H2O2 × (1 mol H2O2 / 34.0 g H2O2) × -98.2 kJ / 1 mol H2O2 = -2.89 kJ
2. 根據我的實驗結果,一次實驗使用過氧化氫的體積為50.0 mL,其分解熱為-4.5 kJ。因此,一瓶400 mL的3.0%外用雙氧水分解後可放出熱量為4.5 kJ × (400 mL / 50.0 mL) = 36 kJ
3. 根據我的實驗結果,一次實驗使用50.0 mL的3.0%外用雙氧水,其分解熱為-4.5 kJ。因此,65 mL的30%過氧化氫可放出熱量為4.5 kJ × (65 mL / 50.0 mL) × (30% / 3.0%) = 59 kJ。
65 mL的水從20℃到100℃需要的能量為65 mL × (1.00 g/mL) × 0.00418 kJ/g℃ × (100℃ – 20℃) = 27.0 kJ。
100℃水可以沸騰的體積為(59 kJ – 27.0 kJ) / [(1.00 g/mL) × 2,26 J/g] = 32 kJ / (2.26 kJ/mL) = 12 mL。
4. 根據題意,液體水和過氧化氫的標準形成焓之兩反應式如下所示:
H2(g) + 1/2O2(g) → H2O(l) △H0f = -285.8 kJ [反應式1] H2(g) + O2(g) → H2O2(l) △H0f = -187.8 kJ [反應式2]
先翻轉[反應式2],然後兩反應式相加,即得過氧化氫的分解焓。
H2(g) + 1/2O2(g) → H2O(l) △H0f = -285.8 kJ [反應式1]
H2O2(l) → H2(g) + O2(g) △H0f = -187.8 kJ [反應式2](翻轉)
———————————————————————
H2O2(l) → H2O(l) + 1/2O2(g) △H = -98.0 kJ
因此,過氧化氫分解成為液體水和氧氣的分解焓為-98.0 kJ/mol。
5. 根據我的測量值,氧化氫的分解焓為-100 kJ/ mol,文獻值為-98.1 kJ/mol,測量值比文獻值為低,實驗誤差為-2%。誤差的可能主要來源為假設3.0%外用雙氧水以及固體混合物溶液的比熱與純水相同,皆用 0.00418 kJ/g℃。實際上,3.0%外用雙氧水以及固體混合物溶液的比熱應該比純水為低。
參考資料和延伸閱讀
- Thermochemistry, Wikipedia, http://en.wikipedia.org/wiki/Thermochemistry.
- Hydrogen peroxide, Wikipedia, http://en.wikipedia.org/wiki/Hydrogen_peroxide.
- The Catalytic Decomposition of Hydrogen Peroxide, http://chemed.chem.purdue.edu/demos/demosheets/19.6.html.
- Bombardier Beetles and Airplane Engines, http://www.apologeticspress.org/articles/2102.
- Bombardier Beetle, http://www.youtube.com/watch?v=j-wVFLucTks.
- Bombardier Beetle Defies Evolution, http://www.youtube.com/watch?v=lKM9yoQ3Wug.
- 阿拉丁神燈與大象的牙膏,2007白沙化學驚奇秀,http://blog.ncue.edu.tw/yangsp/doc/26455。







 前一篇文章
前一篇文章 下一篇文章
下一篇文章 化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應
化學傳記:法拉第不為人知的一面(六):電磁轉動與電磁感應  中間體與穩定狀態近似法
中間體與穩定狀態近似法  【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡
【2014諾貝爾化學獎】如何將光學顯微鏡變成奈米顯微鏡  不需溶劑的紅血球冷凍保存方法
不需溶劑的紅血球冷凍保存方法  2014諾貝爾化學獎的遺珠:結構光照明顯微法
2014諾貝爾化學獎的遺珠:結構光照明顯微法  【2019諾貝爾化學獎】鋰離子電池
【2019諾貝爾化學獎】鋰離子電池 
